1.1. DEFINITION OG FOREKOMST
Tuberkulose (TB) er den kliniske manifestation af infektion med Mycobacterium tuberculosis (MTB). Det er væsentligt at skelne mellem TB, som beskriver klinisk manifest sygdom, og latent MTB infektion (LTBI) der beskriver en asymptomatisk tilstand med et påviseligt immunresponse mod MTB.
På verdensplan er TB en hyppigt forekommende og en udbredt dødsårsag. Der var 10,4 millioner nye TB-tilfælde på verdensplan i 2017, og 1,3 millioner dødsfald(1). Særligt bekymrende var forekomsten af ca. 600.000 nye tilfælde af multiresistent TB (MDR-TB); et problem der er særligt udtalt i Indien, Kina og de tidligere Sovjet-republikker.
I Danmark var incidensen af TB 4,8 tilfælde pr. 100.000 indbyggere i 2017. Af de ialt 275 anmeldte tilfælde, sås de 206 blandt personer med anden etnisk herkomst end dansk (2). TB ses især i særlige risikogrupper. Faktisk er TB ikke en sjælden sygdom i disse mindre og veldefinerede risikogrupper, som foruden indvandrere fra højincidenslande omfatter grønlændere bosiddende i Danmark, socialt udsatte og alkoholiserede danske mænd samt beboere på Christiania i København og i lignende boformer rundt omkring i landet(3).
1.2. Ætiologi
TB og LTBI skyldes smitte med MTB. Smitten sker via aerosoler og dråbekerner ophostet af patienter med lunge-TB. Det følger heraf at det i praksis kun er lunge-TB der smitter. Smitterisikoen afhænger af inokulomets størrelse; denne påvirkes af graden af lungeaffektion og kommunikation med bronkiestystemet, samt af hosteaktiviteten.
Transmissionen af TB varierer ganske betragteligt, men studier har vist at ca. 30% af husstandskontakter i gennemsnit vil blive smittet(4). Risikoen for at udvikle aktiv TB efter eksponering er størst hos børn og immunsupprimerede, herunder HIV-infektion og medikamentel immunsuppression (særligt TNF-hæmmere, men også andre præparater, inklusive kortikosteroider i doser >15 mg/dag).
Bakterierne fagocyteres i lungerne af alveolære makrofager, men er i stand til at etablere intracellulær infektion. Processen leder til dannelse af granulomer, som i de fleste tilfælde holder infektionen under kontrol som latent infektion (LTBI).
Spredning af infektionen sker primært lymfatisk, men kan også foregå hæmatogent eller ved direkte spredning til pleura. Spredning kan give ophav til ekstrapulmonale manifestationer af enhver art, hvoraf infektion i lymfesystemet og i pleura er de hyppigste.
TB inddeles klassisk i primær sygdom, hvor infektionen initielt leder til aktiv sygdom, og post-primær sygdom, hvor immunsystemet mister kontrollen med LTBI, ledende til aktiv sygdom, som kan forekomme mange år efter primær infektion. Post-primær sygdom kan udløses af immunsuppression, malign sygdom, alderdom, men kan også forekomme uden oplagte udløsende årsager.
I de senere år har whole genome sequencing (WGS) givet mulighed for mere detaljerede analyser af smittemønstre og reaktivering. Disse studier har vist at en stor del af de TB-tilfælde som vi traditionelt tilskriver reaktivering, i virkeligheden er resultatet af nylig (re-)infektion(5)
1.3. Kliniske manifestationer
Lunge-TB er den hyppigste kliniske manifestation. Derudover ses hyppigst pleural TB og lymfeknude-TB. Sjældnere ses knogle-TB eller affektion af mave-tarmsystem eller urinveje. CNS-TB udgør en sjælden, men alvorlig manifestation.
Generelt er lunge-TB hyppigst blandt etniske danskere (80%), imens ekstrapulmonal TB ses hos ca. 40% af tilfældene blandt indvandrere fra endemiske områder. Immunsvækkede patienter (inkl. HIV+) kan præsentere sig med vage symptomer, men er i risiko for miliær TB samt alvorlige manifestationer som CNS-TB.
Symptombilledet er særdeles varierende. Generelt ses både almene symptomer og organspecifikke symptomer. Symptomerne indsætter ofte snigende over flere måneder, hvilket i en dansk kontekst ofte kan henlede mistanken på malign sygdom.
Kernesymptomer, der i kombination med relevant eksponering, eller i fravær af anden oplagt forklaring bør føre til udredning for TB, omfatter:
- Feber
- Vægttab
- Nattesved
- Langvarig (purulent) hoste
- Hæmoptyser
- Glandelsvulst
2.1. UDREDNING
Udredningen på mistanke om aktiv TB bygger grundlæggende på 3 elementer: Klinik, radiologi og mikrobiologi.
Dertil kan immunologiske tests (interferon gamma release assays; IGRA) anvendes til at støtte diagnosen. Se særskilt afsnit herom.
Nedenstående gennemgang fokuserer primært på udredning ved mistanke om lunge-TB. Sidst i afsnittet opridses nogle særlige forhold omkring udredning hvis mistanken retter sig mod ekstrapulmonal TB uden lungeinvolvering.
2.2. Klinisk undersøgelse
Indbefatter en grundig objektiv undersøgelse, som journalføres.
Den kliniske undersøgelses hovedformål er:
- At støtte eller rejse en mistanke om TB
- At afdække tegn på relevante differentialdiagnoser
- At afsøge tegn på ekstrapulmonal involvering
2.3. Radiologi
Rtg. thorax tages på alle patienter, også pt. med ekstrapulmonal TB.
Hvis diagnosen er sikker, er der ikke indikation for yderligere radiologiske modaliteter.
CT-thorax anvendes dog ofte til at underbygge diagnosen, og til at skelne TB fra vigtige differentialdiagnoser, først og fremmest lungekræft.
De hyppigste fund på rtg. thorax er:
- Infiltrater, evt. med kavernedannelse
- Pleural effusion
- Hilusadenit
- Skrumpning og fibrose (senstadium)
På CT-thorax kan udover ovenstående ses:
- Tree-in-bud mønster
- Forstørrede mediastinale glandler
2.4. Mikrobiologi
Mikrobiologisk undersøgelse af relevant materiale er hjørnestenen i sikker TB-diagnostik.
En definitiv diagnose beror således på påvisning af MTB ved dyrkning i relevante prøver, selvom negative dyrkninger ikke udelukker TB.
2.4.1 .Prøvetagning
Såvidt muligt tages den første prøve inden opstart af behandling. Prøver fra TB-patienter indeholder oftest et mindre antal bakterier end tilfældet er ved andre infektionssygdomme, men sensitiviteten øges ved at indsende serielle prøver, og ved at sikre sig at prøverne er af god kvalitet.
Ekspektorat: De fleste patienter under mistanke om lunge-TB kan udredes med ekspektorater. Der indsendes mindst 2, og helst 3 prøver af god kvalitet (rigeligt purulent ekspektorat; instruér patienten i at prøven skal ophostes fra brystet(6)).
I praksis er dårlig prøvekvalitet en væsentlig barriere i diagnostikken af TB(7). Ved tvivl om kvaliteten, eller hvis patienten selv indsender prøver, kan der med fordel sendes 3 prøver.
Første prøve tages (om muligt) inden behandlingsopstart. Minimum én af prøverne bør tages om morgenen.
Invasiv prøvetagning: Hvis patienten ikke ekspektorerer, kan der gøres bronkoskopi med BAL eller subsidiært ventrikelskyl x 3.
Øvrige prøver: Ved mistanke om ekstrapulmonal TB sendes relevant materiale fra det afficerede område (fæces, urin, cerebrospinalvæske, glandelbiopsi mv). Blod kan undersøges ved mistanke om miliær TB, men bloddyrkning for MTB er ikke relevant i andre situationer.
Ved mistanke om tuberkuløs pleurit sendes pleuravæske til dyrkning, omend sensitiviteten heraf ikke overstiger 25%. Biopsi af pleura giver væsentligt højere sensitivitet.
2.4.2. Analyseprincipper
Alle prøver der sendes til SSI undersøges med mikroskopi for syrefaste stave samt dyrkning for MTB. Desuden kan der udføres PCR til hurtig identifikation af MTB på mange lokale mikrobiologiske afdelinger.
De beskrevne analyseprincipper anvendes på alle former for prøvemateriale. Sensitiviteten af prøverne er udelukkende baseret på data for ekspektorat-prøver.
Mikroskopi: Udføres som flourescensmikroskopi efter auramin/rhodamin-farvning. Sensitiviteten er ca. 60% ift. dyrkning. Mikroskopi anvendes således primært til vurdering af bakterie-load og dermed smitterisiko. Mikroskopi for syrefaste stave er positiv ved infektion med MTB såvel som med non-tuberkuløse mykobakterier (NTM) og undersøgelsen detekterer såvel levende som døde bakterier, hvorfor den ikke anvendes som behandlingskontrol.
Dyrkning: Er ”gylden standard” i påvisning af MTB. Dyrkning udføres kun på SSI. Den væsentligste ulempe er lang svartid grundet bakteriernes langsomme vækst. Negativt svar gives først efter 8 uger, imens et positivt svar gennemsnitligt udsvares efter 2-3 uger.
Dyrkning for MTB er afgørende for resistensbestemmelse og for genotypisk overvågning af smittekæder.
DNA-baserede metoder: PCR-undersøgelse for MTB er hurtig og giver en samlet sensitivitet på ca. 85%, som afhænger af mængden af bakterier i prøven. PCR for MTB udføres på daglig basis på mange lokale mikrobiologiske afdelinger, foruden på SSI.
PCR rekvireres ved behov for hurtig diagnostisk sikkerhed.
Resistensundersøgelse: Resistensundersøgelser foretages på SSI rutinemæssigt på den første dyrkningspositive prøve fra en patient, og gentages hvis der findes vækst af MTB i en prøve >3 mdr fra den første prøve.
Fænotypisk resistensundersøgelse udføres rutinemæssigt.
Der udføres endvidere rutinemæssigt genotypisk resistensundersøgelse for Isoniazid og Rifampicin.
Risikofaktorer for MDR-TB omfatter især tidligere behandling for TB, kontakt til patient med MDR-TB, og patienter fra lande med høj forekomst af MDR-TB
Tabel 1: Analyser der anvendes i den mikrobiologiske diagnostik af TB
| Analyse | Sensitivitet | Svartid | Bemærkninger |
| Mikroskopi | Ca. 60% ift. dyrkning | Ca. 1 døgn | -Anvendes til vurdering af smitterisiko
-Detekterer døde bakterier, og anvendes derfor ikke til behandlingskontrol |
| PCR | Ca. 85%
(~60% for mik. negative prøver, ~100% for mik. Positive prøver) |
1-2 hverdage | -Anvendes til hurtig diagnostik
-Skelner MTB fra NTM i mik. positive prøver -Detekterer DNA fra døde bakterier, og anvendes derfor ikke til behandlingskontrol |
| Dyrkning | Reference-standard
Detekterer få bakterier/ml |
Op til 8 uger | -Definitiv diagnose
-Nødvendig for resistensundersøgelse og genotypning mhp. sygdomsovervågning |
| PCR for resistensmutationer | Få dage | Udføres rutinemæssigt for 1. linjestoffer og visse 2. linjestoffer | |
| Fænotypisk resistensundersøgelser | 10-14 dage efter positiv dyrkning | Udføres rutinemæssigt på nye dyrkningspositive patienter |
2.5. Histologi
Påvisning af kæmpecellegranulomer, oftest med central nekrose, i relevant biopsimateriale kan understøtte en TB-diagnose, om end fundet ikke er patognomonisk.
Kæmpecellegranulomer kan også ses ved sarkoidose, mb. Gaucher, mb. Crohn, allergisk alveolitis og en række andre sygdomme. I disse sygdomme er granulomerne dog i reglen uden central nekrose. Når den primære mistanke retter sig mod TB, bør biopsimateriale ligeledes sendes til mikroskopi og dyrkning for TB. I tilfælde hvor al materiale er indstøbt i paraffin, er det alligevel muligt at foretage PCR efter særlig oprensning af materialet. Kontakt SSI i sådanne tilfælde, for at sikre korrekt prøvehåndtering.
3.1. IMMUNOLOGISKE TESTS
Immunolgiske tests for MTB-infektion omfatter den over over 100 år gamle tuberkulin skin-test (TST) samt de nyere interferon gamma release assays (IGRA), i Danmark kun omfattende Quantiferon-testen.
3.2. TST
Udføres ved intradermal injektion af 0,1 ml tuberkulin. Testen aflæses 72 timer efter injektion, ved at måle den længste diameter på den fremkomne induration, uden at medtage et evt. omgivende erytem. En induration >6 mm tolkes som et positivt resultat hos ikke-BCG vaccinerede patienter. Testen bør kun udføres af trænet personale.
Ulemper ved testen omfatter især krydsreation med vaccinestammen M. Bovis BCG.
Yderligere information om udførelse af TST kan findes på SSI’s hjemmeside.
3.3. IGRA
Omfatter Quantiferon-testen og Tspot.TB. For øjeblikket udføres kun førstnævnte i Danmark. Quantiferon-testen udføres som en blodprøve, der tages i et kit med 4 antigen-coatede blodprøverør. Sættet omfatter en positiv og negativ kontrol, samt et rør indeholdende antigenerne ESAT-6 og CFP-10 som findes i MTB og nogle ganske få andre mykobakterier, men ikke i m. Bovis BCG. IGRA-tests krydsreagerer således ikke med tidligere BCG-vaccination.
3.4 Tolkning af TST og IGRA
TST og IGRA finder primært anvendelse til undersøgelse af TB-eksponerede personer ved smitteopporing, samt til screening af udvalgte højrisiko-grupper hvor profylaktisk behandling er kost-effektivt. TST og IGRA kan i diagnostikken af aktiv TB anvendes til at understøtte den øvrige diagnostik, men bør kun anvendes efter konference med personer der er vandt til at behandle TB og kan hverken påvise eller udelukke aktiv TB.
Et positivt TST- eller IGRA-resultat påviser et cellulært immunrespons mod MTB. På basis af en række ældre studier, som viste at et positive resultat var forbundet med risiko for senere udvikling af TB, tolkes resultatet som latent TB (LTBI) i fravær af tegn på aktiv TB. Imidlertid vil højst 5-10% af IGRA-positive personer udvikle TB i deres levetid, og den positive prædiktive værdi for aktiv TB i baggrundsbefolkningen er højst 2%(8). Endvidere kan falsk-negative resultater ses, især blandt svært syge TB-patienter, formentlig på grund af akkumulation af TB-specifikke T-celler i vævet fremfor blodet.
4.1. DEN DIAGNOSTISKE PROCES
Diagnostik af aktiv TB omfatter som anført en række undersøgelser, der groft kan inddeles i klinisk undersøgelse, radiologi og mikrobiologi. En række øvrige metoder, herunder histologi og immunologiske tests kan anvendes til at understøtte diagnosen.
Det er afgørende at erindre, at TB i sidste ende er er en klinisk diagnose; hvis patienten således med stor sandsynlighed skønnes at have TB, eller hvis patienten er svært syg og TB mistænkes, indledes behandling straks og uden at afvente svare på mikrobiologiske tests
Radiologien er oftest ”indgangsporten” til videre udredning for TB, imens mikrobiologisk påvisning af MTB er nødvendigt for en sikker diagnose, og ligeledes for at sikre korrekt behandling efter resistensundersøgelser. Det er derfor helt afgørende at fokusere på korrekt prøvetagning, både i forhold til materiale, kvalitet og antal prøver der undersøges. Omvendt skal det atter pointeres, at negative dyrkninger ikke udelukker aktiv TB.
Figur 1. Skitse over workflow ved diagnostik af aktiv TB
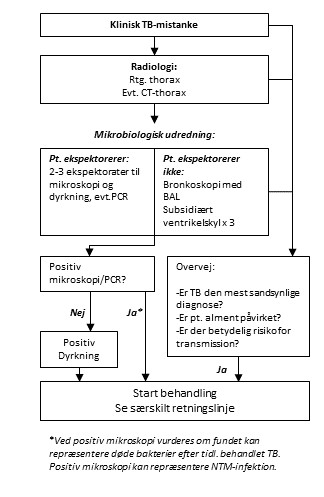
TB-tilfælde klassificeres efter ECDC-klassifikation som bekræftet tilfælde, sandsynligt tilfælde eller muligt tilfælde pba. undersøgelsesfundende, se tabel 2
Tabel 2. ECDC klassifikation af TB-tilfælde
| Bekræftet tilfælde |
Kliniske kriterier opfyldt* |
Påvisning af MTB ved dyrkning
Eller Påvisning af MTB ved PCR OG påvisning af mykobakterier ved mikroskopi
|
| Sandsynligt tilfælde | do. | Påvisning af mykobakterier ved mikroskpi
Eller Påvisning af MTb ved PCR Eller Påvisning af kæmpecellegranulom ved histologi |
| Muligt tilfælde | do. | Ingen af ovennævnte kriterier opfyldt |
* Kliniske kriterier: Fund, symptomer og/eller røntgenfund forenelige med aktiv TB uafhængig af anatomisk lokalisation og en klinikers beslutning om at give et fuldt anti-tuberkuløst behandlingsregime. Efter ECDC.
5.0 LINKS OG YDERLIGERE INFORMATION:
Det nationale tuberkuloseprogram:
Findes i senest opdaterede version på Dansk Lungemedicinsk Selskabs hjemmeside
https://www.lungemedicin.dk/fagligt/klaringsrapporter.html
Diagnostisk håndbog – SSI
Oversigt over analyser og vejledning vedr. mikrobiologisk prøvetagning
https://www.ssi.dk/Diagnostik/DiagnostiskHaandbog.aspx
REFERENCER
- WHO. Global Tuberculosis Report 2017. WHO. 2017.
- Tuberkulose i 2017. Epi-Nyt. 2018;28–33.
- Jensen SG, Olsen NW, Seersholm N, Lillebaek T, Wilcke T, Pedersen MK, et al. Screening for TB by sputum culture in high-risk groups in Copenhagen, Denmark: a novel and promising approach. Thorax. 2015 Oct;70(10):979–83.
- Fox GJ, Barry SE, Britton WJ, Marks GB. Contact investigation for tuberculosis: A systematic review and meta-analysis. Eur Respir J. 2013;41(1):140–56.
- Gardy JL, Johnston JC, Sui SJH, Cook VJ, Shah L, Brodkin E, et al. Whole-Genome Sequencing and Social-Network Analysis of a Tuberculosis Outbreak. N Engl J Med. 2011;364(8):730–9.
- Datta S, Shah L, Gilman RH, Evans CA. Comparison of sputum collection methods for tuberculosis diagnosis: A systematic review and pairwise and network meta-analysis. Lancet Glob Heal. 2017;5(8):e760–71.
- Fløe A, Hilberg O, Thomsen VØ, Lillebaek T, Wejse C. Shortening Isolation of Patients With Suspected Tuberculosis by Using Polymerase Chain Reaction Analysis: A Nationwide Cross-sectional Study. Clin Infect Dis. 2015;23(12):1937–46.
- Zellweger J-P, Sotgiu G, Block M, Dore S, Altet N, Blunschi R, et al. Risk Assessment of Tuberculosis in Contacts by Interferon-γ Release Assays (IGRAs). A TBNET Study. Am J Respir Crit Care Med. 2015;191(10):150312121438001.