1.0 GENERELT
Eosinofile lungesygdomme dækker over en række sygdomme og tilstande karakteriseret ved øget forekomst af eosinofile granulocytter i luftveje og/eller lungeparenkym, abnorm lungeradiologi og lungesymptomer (åndenød og tør hoste). Asymp-tomatiske tilfælde forekommer men er sjældne.
Denne retningslinje fokuserer alene på idiopatiske (primære), parenkymatøse eosinofile lungesyg-domme, men en overordnet klassifikation af eosi-nofile lungesygdomme i såvel luftveje som paren-kym er præsenteret i Figur 1.
1.1 BAGGRUND
Eosinofile granulocytter er myeloide celler og en del af det innate immunforsvar. Ved aktivering secerneres granula med et stort og varieret indhold af både cytotoxiske og pro-inflammatoriske cytokiner.
Perifer eosinofili (> 0,5 x 109/L blod) er hyppigt forekommende og ses ved mange forskellige sygdomme uden dog at være patognomonisk for lungesygdom.
Perifer eosinofili kan opdeles i:
mild: 0,5–1,5 x 109/L
moderat: 1,5–5,0 x 109/L
svær: > 5,0 x 109/L
Følgende punkter er centrale i vurdering af patienten med perifer eosinofili:
• Perifer eosinofili kan være associeret til eller en konsekvens af lungesygdomme.
• Graden af perifer eosinofili afspejler ikke graden af eosinofil inflammation i lungeparenkymet
• Pulmonal eosinofili kvantiteres ved celletælling af bronkoalveolær lavage (BAL).
• Udredning og behandling retter sig både mod primær årsag og mod eosinofili per se.
1.2 INDDELING
Der findes ikke en enkelt internationalt anerkendt klassifikation af eosinofile lungesygdomme. Hyppigst anvendes en klassifikation defineret ved lokalisation (luftveje versus parenkym) og genese defineret som primær ved uerkendt (idiopatisk) årsag/tilstand versus sekundær ved kendt udløsende årsag/tilstand (se Figur 1).
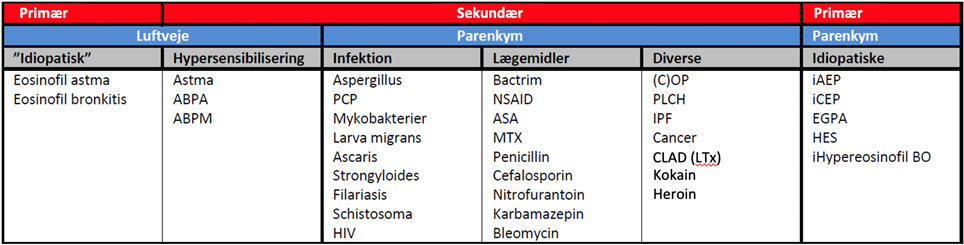
Figur 1: Inddeling af sygdomme og påvirkninger der kan medføre eosinofil inflammation i luftveje (som ikke i øvrigt omtales i denne instruks) og lungeparenkym. Listen over lægemidler og infektioner er ikke komplet. ABPA: Allergisk bronkopulmonal aspergillose. ABPM: Allergisk bronkopulmonal mykose. PCP: Pneumocystis jirovecii pneumoni. ASA: Acetylsalicylsyre. MTX: Methotrexat. (C)OP: (Kryptogen) organiserende pneumonitis. PLCH: Pulmonal Langerhans celle histiocytose. IPF: Idiopatisk pulmonal fibrose. iAEP: Idiopatisk akut eosinofil pneumoni, iCEP: Idiopatisk kronisk eosinofil pneumoni. EGPA: Eosinofil granulomatose med polyangiitis. HES: Hypereosinofilt syndrom. BO: Bronchiolitis obliterans.
1.3 UDREDNING
Patienten med respiratoriske symptomer, lungein-filtrater af evt. flygtig karaktér, og perifer eosinofi-li bør udredes grundigt. Anamnese og den klini-ske tilstand (f.eks. graden af respirations-insufficiens) er afgørende for udrednings- og behandlingsstrategi og hastighed.
Udredning kan kræve involvering af flere specia-ler.
Anamnese
• Medikamentelt induceret eosinofili er hyppigst, hvorfor fokus på medicingennemgang. På www.pneumotox.com findes opdateret liste over lungebivirkninger.
• Rejser, specielt i troperne. Husk at orme- og parasitær infektion kan ligge år tilbage.
• Akut eller kronisk forløb.
• Eksisterende sygdom, herunder astma og atopi.
• Symptomer fra andre organer såsom CNS, PNS, hjerte, mave-tarm, led, muskler, B-symptomer m.m.
Klinik
Pulmonal involvering:
• Respiratoriske symptomer, typisk dyspnø og hoste
• Pulmonale infiltrater (HRCT, CT, røntgen)
Ekstrapulmonal involvering:
• CNS: Encefalopati, kranienerveparese
• PNS: Perifer neuropati, mononeuritis multiplex førende til polyneuropati
• Hjerte: Eosinofil myokarditis, restriktiv kardio-myopati, mitralinsufficiens, perikardie-effusion
• Hud: Palpabel purpura, vaskulitis, urticaria/ angioødem
• Mavetarm: Øvre/nedre dyspepsi, diaré, organ-perforation
• Koagulation: Tromboemboli
• Nyrer: Glomerulonefritis
Paraklinik: biokemi, cytology og mikrobiologi
• Blodprøver: Hgb, trombocytter, leukocytter + diff. tælling, leverenzymer, nyretal, troponin, total IgE, ANA, ANCA. Quantiferon/T-spot/Mantoux
• EKG
• Bronkoskopi: BAL med celletælling anbefa-les, og kombination med histologisk prøve-tagning bør overvejes (TBB eller evt. TBCB), og især i differentialdiagnostisk øjemed ved f.eks. mistænkt vaskulær sygdom (f.eks. EGPA), hvor den perivaskulære infiltration af eosinofile celler kan visualiseres med biopsi
• Dyrkning, mikroskopi og serologi for mikro-organismer
Diagnostiske tests
• Spirometri inkl. diffusion
• Ekkokardiografi (hvis kardial involvering)
• Endoskopi/gastroenterologisk vurdering (hvis mave-tarm involvering)
Billeddiagnostik
• HRCT m.h.p. karakteristik af mønstre og ud-bredelse ved udredning. Ved opflg. Kan rtg. thorax også anvendes
• MR cerebrum (hvis CNS involvering)
1.4 BEHANDLING
Ved moderat eosinofili (> 1,5 x 109/L) og tegn på eosinofil organpåvirkning anbefales systemisk glukokortikoid hurtigst muligt. Såfremt den klini-ske tilstand tillader det, bør det dog tilstræbes at afvente opstart af behandling indtil relevant ud-redning er udført.
Behandlingen afhænger af den tilgrundliggende årsag, f.eks. seponering af farmaka, behandling af infektioner, cancer etc., mens de idiopatiske tilstande primært behandles med glukokortikoi-der.
Glukokortikoider startes kun ved organpåvirkning jf. ovenstående.
I det efterfølgende omtales alene de idiopatiske eosinofile lungesygdomme.
2.0 IDIOPATISK AKUT EOSINOFIL PNEUMONI (iAEP)
2.1 DEFINITION OG FOREKOMST
iAEP kan være årsag til akut og svært respirato-risk svigt hos tidligere lungeraske personer.
• Sjælden med incidens 9,1 per 100.000
• Hyppigst hos 20-40-årige (alle aldersgrupper dog beskrevet)
• Mænd:kvinder i forhold 2:1
• Ca. 2/3 er rygere
• Ingen association til astma
Diagnosen iAEP forudsætter:
• Kortvarig febrilia (oftest < 1 uge) • Progressiv hypoxisk respiratorisk svigt • Diffuse lungeinfiltrater på røntgen • BAL: Eosinofili > 25 % af samlet celletal
• Monoorgansygdom
• Fravær af kendte årsager til eosinofili og pneumoni
2.2 ÆTIOLOGI
Ukendt, men nylig start af tobaksrygning, genop-tagelse af tidligere tobaksrygning eller e-cigaretter, røg- eller støvudsættelse er alle risiko-faktorer associeret til udvikling af iAEP.
2.3 SYMPTOMER OG KLINISKE FUND
Debutsymptomer er uspecifikke som f.eks. akut indsættende feber, dyspnø og non-produktiv hoste, ofte almen utilpashed, myalgier, nattesved og respirations¬synkrone smerter. Typisk progre-dierer iAEP til respirato¬risk svigt med behov for mekanisk ventilation.
Objektivt: Feber, takypnø, hypoxæmi, og bibasal krepitation.
Paraklinisk: Initialt neutrofil leukocytose og normale eosinofile, senere kan der forekomme svær perifer eosinofili. SR og CRP vil typisk være forhøjede.
Røntgen af thorax: Ofte konfluerende og konsoliderede bilaterale infiltrater. Pleuraeffusion (ofte beskeden og bilateral).
HRCT: Overlappende fund i forhold til røntgen af thorax. Der kan desuden ses interlobulær septal fortykkelse, bilateral matglastegning, konsolide-rede infiltrater, fortykkede bronkosvaskulære bundter, centrilobulære noduli, konsolidering af luftveje samt evt. pleuraeffusion (se Figur 2).
Lungefunktionsundersøgelse: Overvejende restrik-tivt ventilationsmønster og nedsat DLCO.
Bronkoskopi: Ofte makroskopisk upåfaldende men BAL med eosinofili > 25 %.
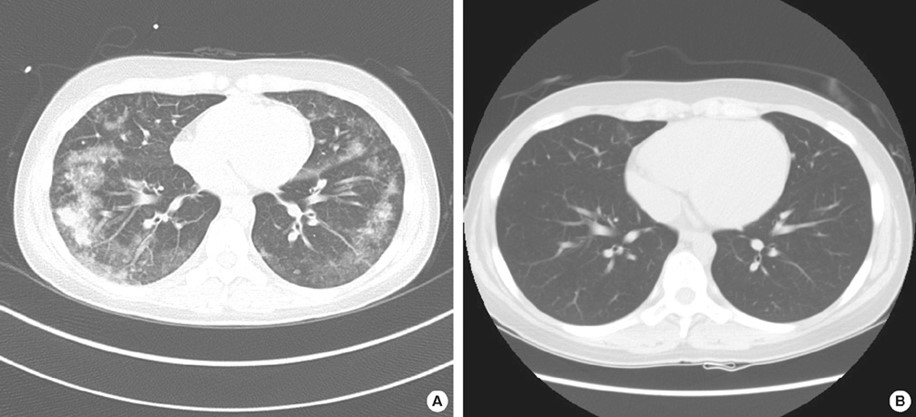
Figur 2: Patient med akut eosinofil pneumoni. Ved indlæggelse (A), og ved opfølgning efter 8 uger (B). Med tilladelse fra patient.
2.4 UDREDNING
Udredningen retter sig primært mod afklaring af langt hyppigere differentialdiagnoser til febrilia og progredierende respiratorisk svigt. Non-infektiøs genese overvejes, når bedring udebliver trods relevant antibiotisk behandling og almen stabilisering, og her er HRCT central til afklaring af differentialdiagnoser som f.eks. hypersensitivitetspneumonitis, organiserende pneumonitis (OP) eller drug-induced interstitiel lungesygdom (DI-ILD) som følge af lægemiddelreaktion. Grundig anamnese inkl. eksponering for partikler er central.
2.5 BEHANDLING
Eneste behandling er systemisk glukokortikoid. Ved respiratorisk svigt: Initialt methylprednisolon 1-2 mg/kg/dag med overgang til tbl. Prednisolon 0,5-1 mg/kg/dag indtil 2-4 uger efter fuld normali-sering af både symptomer og thorax radiologi. Herefter aftrappes med 5 mg/uge. Evidens for behandlingsvarighed er sparsom. Almindeligvis aftrappes over måneder for at undgå relaps. Re-spons på glukokortikoid er eklatant og ses inden for 1-3 dage. Hvis intet respons bør diagnosen revurderes. Der anbefales permanent rygeophør.
2.6 EFTERKONTROL
Prognosen er god, når behandling institueres. Der kan ses recidiv ved for hastig aftrapning af glu-kokortikoid, men herudover er prognosen god med normalisering af lungefunktion og uden sequelae eller recidiv trods evt. respiratorbehand-let svært respiratorisk svigt. Erfaring savnes vedr. anbefalet follow-up varighed, som må foretages på individuel basis.
3.0 IDIOPATISK KRONISK EOSINOFIL PNEU-MONI (iCEP)
3.1 DEFINITION OG FOREKOMST
iCEP er den hyppigst forekommende primære eosinofile pneumoni udenfor tropiske områder, hvor parasitrelateret eosinofil lungesygdom domi-nerer.
• iCEP er en udelukkelsesdiagnose.
• Sjælden, men hyppigst hos midaldrende personer
• Hyppigere hos kvinder end mænd
• Over 50% har kendt astma, og ca. 50% er kendt med atopi, lægemiddelallergi, nasalpo-lypper eller urtikaria
• Ikke associeret til tobaksrygning som ved iAEP
3.2 ÆTIOLOGI
Mekanismen er ukendt. iCEP er en eksklusiondi-agnose, hvorfor sekundære eosinofile pneumoni-er bør udelukkes. Hvis mistanke om f.eks. læge-middeludløst eosinofil pneumoni kan opslag på www.pneumotox.com være med til at sandsynlig-gøre denne sammenhæng.
3.3 SYMPTOMER OG KLINISKE FUND
Sygdomsbilledet er oftest langtrukkent med fe-ber, vægttab, nattesved og åndenød. Sympto-merne er ofte svære, men ikke livstruende.
De diagnostiske kriterier er ikke veldefinerede, men diagnosen forudsætter:
• Relevant anamnese (se ovenfor)
• Blod: Perifier eosinofili
• BAL: Eosinofili > 25%
• Røntgen af thorax/HRCT: Perifere, migreren-de infiltrater adskilt af matglastegning og normalt lungevæv. Infiltrater (evt. migrerende) ses ofte apikalt eller perifert beliggende. Det radiologiske fund ”fotografisk negativ af lun-geødem” ses hos ca. 25% med iCEP (se Fi-gur 3).
• Lungefunktionsundersøgelse: Ca. halvdelen af patienterne har obstruktivt mønster, resten har restriktivt. Oftest nedsat DLCO.
3.4 UDREDNING
Udredningen retter sig primært mod afklaring af differentialdiagnoser til almensymptomer og pulmonale infiltrater (f.eks. malignitet, infektioner (f.eks. parasitter), pulmonal sarkoidose, OP og toksiske årsager) og indbefatter bl.a. leukocyt-differentialtælling, HRCT og bronkoskopi med BAL til celletælling. Grundig medicinanamnese er fundamental.
NB: Fravær af eosinofili i BAL eller perifer eosino-fili kan skyldes forudgående behandling med glukokortikosteroid.
3.5 BEHANDLING
Hjørnestenen i behandling af iCEP er systemiske glukokortikoider. Der ses klinisk remission inden-for få dage, mens radiologisk remission tager længere tid. Der anbefales prednisolondosis sv.t. 0,5-1,0 mg/kg/dag. Prednisolon er effektivt og aftrappes som hovedregel langsomt over 6-12 måne¬der, idet hurtig udtrapning vil medføre relaps hos op til 80%.
Prednisolon udtrapningsforslag:
• Uændret initialdosis indtil 2 uger efter klinisk og radiologisk remission: derefter halveres dosis efter 4 uger: aftrappes med 5 mg/4. uge med individualiseret klinisk kontrol under-støttet af eosinofiltal og evt. røntgen thorax indtil 10 mg/dag, hvor der gøres status.
• Dernæst aftrappes med 2,5 mg/4. uge indtil behandlingsophør. Der anbefales klinisk kon-trol understøttet af eosinofiltal og evt. røntgen 4-12 uger efter udtrapning eller hvis tegn til recidiv.
3.6 EFTERKONTROL
Prognosen er god. Imidlertid kan vedvarende obstruktion trods behandling ses hos nogle pati-enter, hvor der kan være behov for langtidsbe-handling op til flere år og således også behov for længerevarende opfølgning.
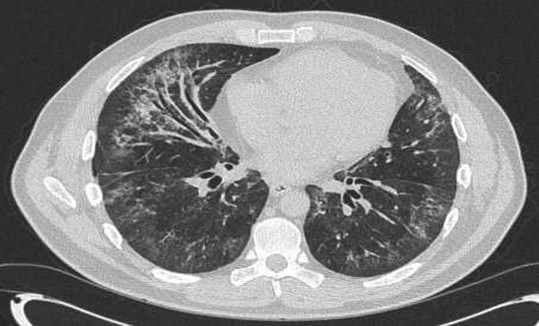
Figur 3: HRCT thorax: Patient med iCEP. Bemærk de klassiske perifere infiltrater. Med tilladelse fra patient.
4.0 EOSINOFIL GRANULOMATOSE MED PO-LYANGIITIS (EGPA (tidligere ”Churg-Strauss”))
4.1 DEFINITION OG FOREKOMST
EGPA er en autoimmun lidelse, der sammen med sygdommene granulomatose med polyangiitis (GPA: tidligere ”Wegeners granulomatose”) og mikroskopisk polyangiitis (MPA) udgør sygdomsgruppen antineutrofil cytoplasmisk antistof (ANCA)-associerede vaskulitter (AAV). Astma forekommer hos alle patienter, mens kronisk rhinitis ses hos 75%. Allergi synes at styrke diagnosen.
EGPA er en sjælden lidelse med en årlig incidens på ca. 0,5-6,8 per million.
Traditionelt er lidelsen karakteriseret ved følgende kriterier:
- Astma
- Eosinofili:
Blod > 1,5 x 109 /L i blod og/eller
BAL > 25%
Lungebiopsi med extravaskulær eosinofilo-cyt infiltration
- Extrapulmonal manifestation (≥ 1):
Extrapulmonal biopsi med vaskulitis (hud, muskel, nerve, nasalmukosa, sinusmukosa)
Mononeuritis multiplex
Palpabel purpura
Kardiomyopati
Positiv ANCA (PR3 el MPO)
4.2 ÆTIOLOGI
ANCA spiller en vigtig rolle for sygdomsudviklin-gen. Antistofferne medfører degranulering af de neutrofile granulocytter og dermed endotelskade. Der er en mulig arvelig komponent i sygdomsud-viklingen.
4.3 SYMPTOMER OG KLINISKE FUND
Sygdommen præsenterer sig i 3 faser: 1. fase består af prodromalsymptomer med astma og rhinit og evt. sinuitlignende symptomer. 2. fase inkluderer perifer eosinofili og migrerende eosino-fil infiltration i organer såsom lunger, hjerte, og mave-tarm kanalen. 3. fase er vaskulit-fasen med almensymptomer i form af træthed, anorexi, fe-ber, muskel- og ledsmerter. Fra og med 2. fase kan der forekomme svær multiorganpåvirkning.
4.3 UDREDNING
Som ved øvrige lungesygdomme med præsentation af perifer eosinofili. Specielt ANCA mod myeloperoxidase (MPO) og proteinase-3 (PR3) er relevante ved AAV, men hos ca. 50% præsenterer EGPA sig med negativ ANCA.
Andre specialer såsom kardiologi, nefrologi, reumatologi og neurologi bør ofte involveres i udredningen. Særlig tilrådes kardiologisk udredning, da der kan forekomme hjertesvigt pga. eosinofil myokardit eller arteriitis i koronarkarrene. Den kardielle involvering forværrer den overordnede prognose betydeligt, og kan gå fra at være asymptomatisk til at resultere i pludselig akut kardial sygdom.
4.4 BEHANDLING
Behandlingen bør altid foregå i samarbejde med reumatologi og øvrige relevante specialer.
Initialbehandling består af systemisk glukokortikoid i form af methylprednisolon bolus (15 mg/kg/dag) i 1-3 dage, efterfulgt af tbl. Prednisolon 1 mg/kg/dag i 3-4 uger. Herefter nedtrapning til vedligeholdelsesbehandling med tbl. Prednisolon 10-15 mg dagligt i op til et år. Mepolizumab (anti-IL5) er desuden godkendt som tillægsbehandling til patienter over 6 år med recidiverende eller refraktær EGPA. Endvidere kan tillæg af Cyclofosfamid eller Rituximab anvendes ved svær generaliseret sygdom. Ofte suppleres med Azathioprin som recidivprofylakse i 18-24 mdr. efter remission.
4.5 EFTERKONTROL
5-års overlevelsen er op til 95%, men idet der er risiko for recidiv bør patienterne følges tæt af alle relevante specialer som reumatologi og kardiolo-gi.
5.0 HYPEREOSINOFILT SYNDROM (HES)
HES er en heterogen gruppe af sygdomme defi-neret ved:
• Moderat/svær hypereosinofili (> 1,5 x 109/ml) ved to uafhængige målinger i > 6 måneder og/eller
• Tegn på eosinofil organpåvirkning
• Eksklusion af kendt årsag til eosinofili (se figur 1)
Prævalens og incidens er ukendt, men HES er et sjældent syndrom som hyppigst rammer personer i alderen 20-60 år. HES dækker over flere syg-domskategorier med meget forskellig prognose, herunder flere maligne hæmatologiske lidelser, hvorfor hæmatologisk vurdering af patienten an-befales tidligt i forløbet.
Også ved HES er Mepolizumab (anti-IL5) indiceret som en tillægsbehandling til voksne patienter med utilstrækkeligt kontrolleret HES uden en iden-tificerbar ikke-hæmatologisk sekundær årsag, og har vist lovende resultater i.f.a. hurtigere opnået sygdomskontrol, reduceret perifer eosinofili samt mulighed for reduceret dosis af systemisk gluko-kortikosteroid.
Der er oprettet formaliseret samarbejde med højt-specialiseret funktion vedrørende udredning og behandling af HES ved hhv. Center for EOSinofili (OUH/CEOS) for Vestdanmark, og Center ved RigsHospitalet for EOSinofili (RHEOS) for Øst-danmark.
6.0 REFERENCER
1. Alberts WM. Eosinophilic interstitial lung dis-ease. Curr. Opin. Pulm. Med. 2004;10:419-24.
2. Jeong YJ, Kim KI, Seo IJ, Lee CH, Lee KN, Kim KN et al. Eosinophilic lung diseases: a clinical, radiologic, and pathologic overview. Radiograpics 2007;27:617-37.
3. Katz U, Shoenfeld Y. Pulmonary eosinophilia. Clin. Rev. Allergy Immunol. 2008;34:367-71.
4. Wechsler ME. Pulmonary eosinophilic syn-dromes. Immunol. Allergy Clin. North Am. 2007; 27:477-92.
5. Alam M, Burki NK. Chronic eosinophilic pneumonia: a review. South. Med. J. 2007;100: 49-53.
6. Simon D. Organ-specific eosinophilic disor-ders of the skin, lung, and gastrointestinal tract. J. Allergy Clin. Immunol. 2010;1263-13.
7. Masi AT. Hunder GG. Lie JT. Michel BA. Bloch DA. Arend WP. Calabrese LH. Edwor-thy SM. Fauci AS. Leavitt RY. et al. The Amer-ican Col-lege of Rheumatology 1990 criteria for the classification of Churg-Strauss syn-drome (al-lergic granulomatosis and angiitis). Arthritis & Rheumatism. 1990;33:1094-100.
8. Youn JS, Kwon JW, Kim BJ, Hong SJ. Smok-ing-Induced Acute Eosinophilic Pneumonia in a 15-year-old Girl: A Case Report. Allergy Asth-ma Immunol Res. 2010;2:144-14118.
9. Fernández Pérez ER, Olson AL, Frankel SK. Eosinophilic lung diseases. Med Clin North Am. 2011;95:1163-87.
10. Cottin V. Eosinophilic Lung Diseases. Clin Chest Med. 2016;37:535-56.
11. Cordier JF, Cottin V, Guillevin L, Bel E, Bot-tero P, Dalhoff K, Humbert M, Lazor R, Sinico RA, Sivasothy P, Wechsler ME. L5. Eosino-philic granulomatosis with polyangiitis (Churg-Strauss). Presse Med. 2013;42:507-10.
12. Gleich GJ, Roufosse F, Chupp G, Faguer S, Walz B, Reiter A, Yancey SW, Bentley JH, Steinfeld J; HES Mepolizumab Study Group. Safety and Efficacy of Mepolizumab in Hy-pereosinophilic Syndrome: An Open-Label Extension Study. J Allergy Clin Immunol Pract. 2021;9:4431-4440.e1.
13. Jackson DJ, Wechsler. Eosinophilic Lung Diseases. ERS Monograph 2022.
14. Moosig F, Bremer JP, Hellmich B, Holle JU, Holl-Ulrich K, Laudien M, Matthis C, Metzler C, Nölle B, Richardt G, Gross WL. A vasculitis centre based management strategy leads to improved outcome in eosinophilic granulo-matosis and polyangiitis (Churg-Strauss, EGPA): monocentric experiences in 150 pa-tients. Ann Rheum Dis 2013;72:1011-7.
15. Hougaard M, Thomsen GN, Kristensen TK, Lindegaard HM, Davidsen JR, Hartmeyer GN, Kjeldsen AD, Martin-Iguacel R, Maiborg M, Assing K, Andersen CL, Broesby-Olsen S, Møller MB, Vestergaard H, Bjerrum OW. A retrospective cohort study of patients with eosinophilia referred to a tertiary centre. Dan Med J 2022;69:A07210558.
16. Thomsen GN, Christoffersen MN, Lindegaard HM, Davidsen JR, Hartmeyer GN, Assing K, Mortz CG, Martin-Iguacel R, Møller MB, Kjeld-sen AD, Havelund T, El Fassi D, Broesby-Olsen S, Maiborg M, Johansson SL, Ander-sen CL, Vestergaard H and Bjerrum OW (2023) The multidisciplinary approach to eo-sinophilia. Front. Oncol. 13:1193730.
doi: 10.3389/fonc.2023.1193730