1.1. INTRODUKTION
Pulmonale aspergilloser er en sygdomskategori, der overordnet involverer nedenstående undertyper:
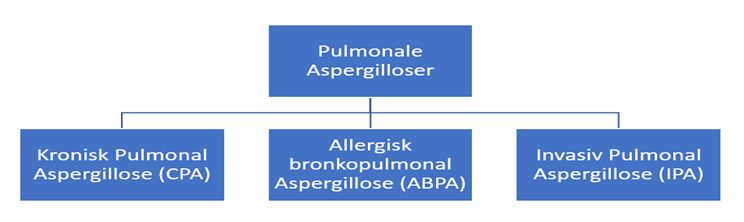
Figur 1.Undertyper af pulmonale aspergilloser.
Denne vejledning omhandler alene kronisk pulmonal aspergillose (eng.:chronic pulmonary aspergillosis (CPA)).
1.2. DEFINITION OG BAGGRUND
Kronisk Pulmonal Aspergillose (CPA) er en underdiagnosticeret, progressiv og destruktiv saprofytær infektion, der primært rammer patienter, som i forvejen er kendt med strukturel lungelidelse. Diagnostik af CPA kan være kompleks og udfordrende. Sygdommen har en høj morbiditet og en mortalitet, som ubehandlet langt overstiger flere typer af cancer såfremt. En tidlig identifikation af patienter, der er i risiko for at udvikle CPA er derfor essentiel for opnåelse af hurtigere diagnostik og initiering af behandling således, at morbiditet og mortalitet kan reduceres. Behandlingen er ofte langvarig, og kan være livslang ved sygdomsrelaps.
CPA er en paraplydiagnose, der indeholder flere subtyper:
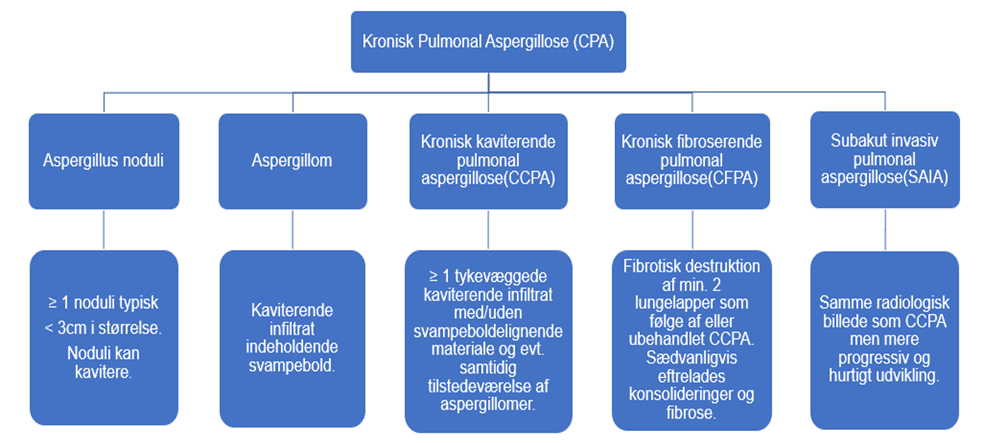
Figur 2.Subtyper af kronisk pulmonal aspergillose (eng.:chronic pulmonary aspergillosis(CPA)).Kronisk kaviterende pulmonal aspergillose(eng.:chronic cavitating pulmonary aspergillosis(CCPA), kronisk fibroserende pulmonal aspergillose (eng.:chronic fibrosing pulmonary aspergillosis(CFPA)),subakut invasiv pulmonal aspergillose(eng.:subacute invasive pulmonary aspergillosis(SAIA)).
1.3. ÆTIOLOGI
Aspergillus species er saprofytær forekommende skimmelsvampe, der vokser med spordannende hyfer, og som findes overalt i naturen. Der er mere end 250 subspecies men kun få er humant patogene, hvor Aspergillus fumigatus er den hyppigste ved CPA.
1.4. KLASSIFIKATION
Den mest almindelig form for CPA er kronisk kaviterende pulmonal aspergillose (CCPA). Ved immuninkompetente patienter kan ubehandlet CCPA undertiden udvikle sig til subakut invasiv aspergillose (SAIA) men kan omvendt ophele til kronisk fibroserende pulmonal aspergillose(CFPA) efter veloverstået infektion og/eller behandling. CFPA betragtes som slutstadiet af CPA.CPA skal anses som et kontinuum af subtyper, som udvikles i forskellige retninger afhængigt af værtens underliggende lungeanatomi og immunstatus, og de forskellige subtyper kan i enkelte tilfælde udvikle sig uden forudgående CCPA.
Andre manifestationer af CPA omfatter aspergillus noduli og aspergillom. CPA og dennes subtyper opstår overvejende hos patienter, der besidder en eller flere risikofaktorer, og samtidig har strukturel lungesygdom (se punkt 1.5).
SAIA (tidligere benævnt semiinvasiv eller kronisk nekrotiserende pulmonal aspergillose) er en hurtig fremadskridende infektion (<3 måneder), som primært skal mistænkes hos immunsupprimerede eller svækkede patienter med erhvervet nedsat immunitet (se punkt 1.5). SAIA har lignende kliniske og radiologiske træk som CCPA, men progredierer hurtigere.
Det kan være vanskeligt at skelne CCPA og SAIA uden patologisk tegn på hyfeinvasion af lungevæv og/eller sikre oplysninger om progression over tid.
Tabel 1: CPA subtyper.
| CPA subtype | Karakteristika |
| Aspergillus noduli | · Radiologisk fund af enkelt eller flere noduli <3 cm, som kan evt. kavitere.
· Serologisk og mikrobiologisk evidens for Aspergillus-species. · Oftest asymptomatisk. |
| Aspergillom | · Radiologisk fund af rund, tyndvægget kavitet i overlapperne indeholdende en/flere svampebolde og luft i form af det klassiske ”air crescent sign.” Er oftest uden radiologisk progression gennem 3 mdr.
· Serologisk og mikrobiologisk evidens for Aspergillus-species. · Oftest ingen eller få symptomer. |
| Kronisk kavitierende pulmonal aspergillose
(CCPA) |
· Radiologisk progression med uni- eller bilateralt nye kaviterende infiltrater associeret med multiple ekspanderende tykvæggede kavititeter, der kan indeholde aspergillomer med konkomitant perikavitær pleural fortykkelse i varierende grad, perikavitære infiltrater eller fibrose.
· Serologisk og mikrobiologisk evidens for tilstedeværelse af Aspergillus-species. · Oftest symptomatisk (Se afsnit 1.6). |
| Kronisk fibrosierende pulmonal aspergillose (CFPA) | · Typisk radiologi med fibrotisk destruktion af lungevævet, som involverer en af eller begge overlapper men kan involvere hele hemithorax. Der er intet karakteristisk træk ved fibrose relateret til CPA men opstår i relation til kaviteter med svampebold. |
| Subakut invasiv pulmonal aspergillose (SAIA) | · Lignende radiologisk træk som CCPA, men med hurtigere udvikling.
· Histologisk prøvetagning fra lungevæv med fund af hyfeindvækst i lungevæv og/eller Aspergillus-species. · Serologisk og mikrobiologisk evidens af tilstedeværelse af Aspergillus- species: mikroskopi, dyrkning eller Aspergillus-galactomannan i BAL og evt. blod. · Hurtigt udviklende symptomer (Se afsnit 1.6). |
1.5. RISIKO FAKTORER FOR UDVIKLING AF CPA
Tabel 2: Risikofaktorer for udvikling af CPA.
| Strukturelle lungesygdomme | Erhvervet nedsat immunitet |
| Tuberkulose | Diabetes mellitus (DM) |
| Non -Tuberkuløs mykobakteriose (NTM) | Hjerte-, nyre-, og leverinsufficiens |
| Emfysem | Alkoholisme |
| Interstitielle lungesygdomme (ILS) med fibrose | Malnutrition |
| Lungecancer | HIV |
| Bronkiektasier | Immunsuppressiv behandling inklusive stråleterapi for lungekræft. |
| Sarkoidose | Immuninkompetente tilstande (solid organtransplantation, hæmatologiske sygdomme, autoimmune sygdomme, immundefekter, cancer) |
1.6. SYMPTOMER
Da CPA typisk opstår hos patienter med præeksisterende kronisk lungesygdom overlapper symptomer ved CPA ofte symptomer, som optræder ved andre lungesygdomme.
Produktiv hoste med ekspektoration, dyspnø, uspecifikke brystsmerter og hæmoptyse er klassiske symptomer på CPA. Hæmoptyse kan optræde ved især aspergillom eller kaviterende infiltrater, der involverer pulmonalkar. Herudover vil patienter med CPA ofte også opleve B -symptomer (utilsigtet vægttab, nedsat appetit, træthed og nattesved).
1.7. DIAGNOSTIK OG UDREDNING
Diagnostik af CPA er udfordrende og kræver en systematisk tilgang til vurdering og fortolkning af resultater. Der findes ikke en entydig test til diagnostik af CPA. Diagnosen kræver som udgangspunkt identifikation af patienter i risiko for at udvikle CPA kombineret med fund, der indikerer infektion ved f.eks. klassiske radiologiskfund samt mykologisk evidens på eksponering/kolonisering/infektion med Aspergillus species.
Alle følgende diagnostiske kriterier skal være opfyldt for at stille diagnosen CPA:
- Radiologi med ≥ 1 kavitet +/- svampebold (Aspergillom) og/eller noduli.
- Positiv test for Aspergillus species (serologi, mikroskopi, dyrkning).
- Eksklusion af alternative diagnoser, som f.eks. lungekræft, sarkoidose, tuberkulose, TB, NTM.
- Symptomvarighed > 3 måneder.
Radiologi:
Konventionel røntgen af thorax er typisk den primære undersøgelse og kan evt. vise forandringer i lungeparenkymet, der giver mistanke om CPA. Kontrast forstærket CT skanning af thorax anses som reference standard ved radiologisk udredning af CPA og udmærker sig ved at kunne belyse udbredelsen af forandringer i lungeparenkymet samt karakteristika for subtype, og endvidere være retningsgivende for, fra hvilken lokalisation invasiv diagnostisk prøvetagning anbefales. Validerede fund til monitorering af CPA er ligeledes baseret på fund ved CT.
Serologi:
Måling af Aspergillus fumigatus IgG er central ved udredning for CPA. Ud over anvendelsen i diagnostisk øjemed (kriterie 2) anvendes måling af Aspergillus fumigatus IgG som monitorerings- redskab, hvor værdierne forventes at falde ved succesfuld behandling, hvorimod en stigning af værdierne under behandling indikerer nonkomplians, resistens over for det givne antifungale middel eller evt. behov dosisintensivering. Aspergillus fumigatus IgE har ikke en rolle i CPA diagnostik, men anses som værende del af initiale standard diagnostik i forhold til differentiering imellem andre PA typer som f.eks. ABPA.
Cellevægskomponenter:
Aspergillus’ cellevæg indeholder ca. 25% galactomannan (GM), som ved påvisning kan indikere aktiv Aspergillus infektion. GM kan måles i blod, BAL og CSF. Positiv BAL GM vil indikere lungeinfektion med Aspergillus og understøtte en CPA-diagnose (kriterie 2), hvorimod påvisning af GM i blod bør rejse mistanke om evt. IPA eller SAIA.
Mikroskopi, histologi og dyrkning: Mykologisk evidens for CPA kan ligeledes opnås ved positive mikroskopiske, mikrobiologiske eller histologiske fund af Aspergillus species (kriterie 2).
Ekspektorat eller bronkoskopisk udført BAL og protected specimen brush og/eller histologiske prøver (MB, TBB, TTNAB) kan undersøges for Aspergillus species ved dyrkning og mikroskopi efter special farvning. Sensitiviteten for både mikroskopi og dyrkning er under 50%, hvorfor et negativt resultat ikke kan udelukke Aspergillus infektion. Fund af Aspergillus- species i ekspektorat dyrkning er ikke alene diagnostisk for CPA og kan indikere kontaminering eller kolonisering med Aspergillus species frem for infektion og vil derfor altid kræve klinisk fortolkning, understøttet af andre diagnostiske tests.
Fund af hyfeinvasion ved mikroskopi af histologiske materiale konfirmerer invasiv Aspergillus infektion hvor SAIA eller IPA bør mistænkes.
Molekylær undersøgelse:
Påvisning af Aspergillus species DNA ved PCR-teknik viser en høj sensitivitet i BAL, men kan ved påvisning i BAL eller ekspektorat ikke skelne kolonisering fra aktiv infektion, og vil derfor altid kræve klinisk fortolkning, understøttet af andre diagnostiske tests inklusiv radiologi. Ved PCR kan kun identificeres enkelte resistensmutationer, hvorfor konventionel dyrkning med resistensbestemmelse er PCR resistensbestemmelse overlegent.
1.8. SCREENING
Der foreligger begrænset viden omkring effekt af systematisk screening for CPA blandt risikopatienter, men følgende patient kategorier anbefales rutinemæssig screening for CPA:
- Patienter med påvisning af radiologi der kan være forenelig med CPA (f.eks. kaverner eller aspergillom).
- Patienter med påvist eller mistænkt mykobakteriose (TB / NTM).
1.9. BEHANDLING
Non-farmakologisk behandling
- Optimering af behandling af underliggende sygdom eller risikofaktor (f.eks. DM)
- Immunsupprimerende midler inklusiv inhaleret og systemiske steroider udgør en stor risikofaktor for udvikling og progression af CPA, derfor skal dosis reduktion, omlægning til anden medikament eller evt. Seponering af immunsupprimerende behandling altid overvejes hos pt med CPA.
- Henvisning til diætist og/ eller fysioterapeut bør overvejes ved nedsat almen eller ernæringstilstand.
Farmakologisk behandling
- Farmakologisk behandling af CPA er en specialistopgave idet kendskab til antifungale præparaters virkning, interaktioner og bivirkninger er en forudsætning for at kunne varetage behandling.
- CPA behandles primært med azoler, hvor det overordnede behandlingsmål er at opnå infektionskontrol samt reduktion i sygdomsprogression og symptombyrde.
- Da behandlingsmål er at opnå infektionskontrol samt reduktion i sygdomsprogression og symptombyrde, vil farmakologisk behandling ikke være indiceret hvis tilstanden forud for udredning har været klinisk eller radiologisk stabil.
- Azoler er bivirkningstunge præparater (kvalme, opkastning, neuropati, medikamentel hepatitis, symptomer fra nervesystem, hududslæt og QT-forlængelse).
- Azoler er cytokrom P450-inihibitorer, hvorfor systematisk gennemgang af øvrig medicin med hepatisk metabolisme er obligat forud for behandlingsvalg og initiering.
- Hjemmesiden (http:/interaktionsdatabasen.dk) kan benyttes til at belyse interaktioner mellem azoler og andre medikamenter.
- Behandlingsvarighed med azoler er minimum 6 mdr. og kan evt. forlænges afhængigt af sygdommens respons på behandling eller i tilfælde af immunsuppression.
- Behandlingen skal så vidt muligt baseres på en resistensbestemmelse, hvor generelle anbefalinger for non-SAIA CPA subtyper er: itraconazol, voriconazol, posaconzazol, isavuconazol i nævnt rækkefølge. For SAIA vil tilgangen være Voriconazol som 1. valg efterfulgt af posaconazol og Isavuconazol.
- Ved azoleintolerans eller resistens kan andre behandlingstiltag komme på tale i form af f.eks. inhaleret amphotericin B eller kortvarig i.v.-behandling med echinocandin. Ligeledes bør man ved azolresistens afsondre muligheden for kirurgisk intervention.
- Komplekse kliniske problemstillinger og udfordringer ved behandling anbefales drøftet i et multidisciplinært team samarbejde med inklusion af specialister inden for lungemedicin, klinisk mikrobiologi, klinisk immunologi, thoraxkirurgi, radiologi og patologi. Ved behov kan patienter henvises til vurdering / second opinion ved Pulmonalt Aspergillose Center Danmark (PACD) placeret på Lungemedicinsk Afd. J på Odense Universitetshospital.
Behandling og observation af CPA subtyper
- Da Aspergillomer og Aspergillus noduli oftest vil være asymptomatiske, vil observation uden farmakologisk behandling være 1. valg I tilfælde af symptomer kan azol behandling være indiceret jf. non-SAIA CPA tilgang.
- I tilfælde af større, recidiverende eller livstruende hæmoptyse kan evt. en kirurgisk resektion eller emobilisering være indiceret. Evt. kirurgisk tilbud bør varetages i tæt formaliseret multidisciplinært samarbejde.
1.10. KONTROL, OPFØLGNING OG TERAPEUTISK DRUG MONITORERING (TDM)
- Omfatter klinisk og paraklinisk kontrol af CPA, og ved iværksat farmakologisk behandling afklaring af evt. bivirkninger og mulig justering af dosis i.f.t behandlingsrespons.
- Terapeutisk drug monitorering (TDM) er en vigtig del af kontrol efter initiering af azolterapi. Typisk måles azol koncentrationer i plasma i den første uge (7 dage for itraconazol og posaconazol og mellem 2-5 dage for voriconazol) efter behandlingsopstart og regelmæssigt efterfølgende for at sikre opnåelse af terapeutisk index for det gældende azolpræparat, og ikke mindst for at undgå toksisitet. Måling foretages inden indgift af morgendosis som ”dalværdi.”
- TDM suppleres med månedlig kontrol af biokemi inkl. hæmatologi, væsketal og leverenzymer.
- EKG bør foretages efter påbegyndt behandling såfremt patienten får andre medikamenter med risiko for QT-forlængelse.
- Som udgangspunkt anbefales klinisk kontrol hver 3-6 mdr. med ovennævnte biokemi og Aspergillus serologi, men kontrolfrekvensen justeres ud fra samlet vurdering af sygdomsaktivitet.
- Radiologisk kontrol med f.eks. lav dosis CT-thorax under farmakologisk behandling anbefales ca. hver 3-6 mdr. da radiologiske forandringer udvikler sig.
- PET-CT kan anvendes i udvalgte tilfælde hvis der er tvivl om sygdomsaktivitet eller hvis PET-CT vil kunne hjælpe til at vejlede supplerende invasiv diagnostik eller i differential diagnostisk øjemed
REFERENCER
- Davidsen JR, Rosenvinge FS, Assing K, Laursen CB et al. Kroniske pulmonale aspergillose. Ugeskr Laeger. 2018;180(5):V05170434.
- Denning DW, Cadranel J, Beigelman-Aubry C et al. Chronic pulmonary aspergillosis: rationale and clinical guidelines for diagnosis and management. Eur Respir J. 2016;47(1):45-68
- Kanj A, Abdallah N, Soubani NO et al. The spectrum of pulmonary aspergillosis. Respir Med. 2018;141:121-131.
- Kosmidis C, Denning DW et al. The clinical spectrum of pulmonary aspergillosis. Thorax.2015;70(3):270-77.
- Gao Y, Soubani A et al. Advances in the diagnosis and management of pulmonary aspergillosis. Adv Resp Med. 2019;87(6):231-43.
- Ye F, Zenc P, Li Z et al. Detection of Aspergillus DNA in BALF by Real-time PCR and Galactomannan Antigen for the Early Diagnosis of Chronic Pulmonary Aspergillosis. Ann Clin Lab Sci. 2021;51(5):698-704.
- Ashbee HR, Barnes RA, Johnson et al.Therapeutic drug monitoring (TDM) of antifungal agents: guidelines from the British Society for Medical Mycology. J antimicrobe Chemother. 2014;69(5):1162-76.
- Izumikawa K, Yamomoto Y, Mihara T et al. Bronchoalveolar lavage galactomannan for the diagnosis of chronic pulmonary aspergillosis. Med Mycol. 2012;50(8):811-7.
- Klinting FP, Laursen CB, Titlestad I. Incidence of Chronic Pulmonary Aspergillosis in Patients with Suspected or Confirmed NTM and TB-A Population-Based Retrospective Cohort Study. J Fungi (Basel). 2022;8(3):301.
- Rønberg R, Davidsen, Salzer HFJ et al. Prevalence of Chronic Pulmonary Aspergillosis in Patients Suspected of Chest Malignancy. J Fungi (Basel). 2022;8(3):297.