1 Akut exacerbation af IPF
1.1. DEFINITION
Akut exacerbation af idiopatisk pulmonal fibrose (AE-IPF) er en klinisk signifikant akut respiratorisk forværring karakteriseret ved ny og udbredt alveoleskade hos patienter med IPF.
1.1.1. Diagnostiske kriterier for AE-IPF
- Kendt eller mistænkt IPF
- Forværring af dyspnø, typisk <1 måned
- Nyopståede fund på CT thorax: Bilaterale matglasforandringer og/eller konsolideringer oveni det eksisterende usual interstitial pneumonia (UIP) mønster
- Symptomerne ikke fuldt forklaret ved andre årsager (fx hjertesvigt eller lungeemboli)
1.2. FOREKOMST
Incidensen af AE-IPF er usikker og afhænger af, hvilken definition der er benyttet, hvilken population der undersøges, og om man inkluderer både mistænkte og sikre tilfælde af AE-IPF. Baseret på populationer fra randomiserede og observationelle studier, estimeres incidensen til ca. 4-20 per 100 personår hos patienter med IPF.
1.3. ÆTIOLOGI
Ætiologien til AE-IPF er ikke endeligt klarlagt. AE-IPF kan være idiopatisk eller sekundær til en ekstern trigger, som fx infektion, kirurgi eller aspiration.
Virale og bakterielle infektioner kan udløse en AE-IPF, hvilket formentlig er forklaringen på, at exacerbationer opstår hyppigere om vinteren og foråret. Derudover kan AE-IPF udløses af thoraxkirurgiske indgreb og procedurer (fx VATS lungebiopsi eller lungecancer resektion). AE-IPF efter kirurgiske indgreb udenfor thorax eller efter invasive diagnostiske procedurer (fx BAL og transbronkial cryobiopsi) er beskrevet i case series. Også aspiration kan udløse en AE-IPF, men anti-reflux kirurgi har ikke kunnet reducere incidensen i et mindre randomiseret kontrolleret studie.
1.4. FOREBYGGELSE
Forebyggelse af AE-IPF retter sig mod de kendte udløsende årsager, fx kan man forsøge at reducere risikoen for infektioner, vaccinere mod luftvejsinfektioner og undgå thoraxkirurgiske indgreb, hvis det er muligt.
Derudover kan fast behandling med antifibrotisk medicin reducere risikoen for AE-IPF.
1.5. SYMPTOMER OG KLINISKE FUND
1.5.1. Symptomer
Symptomerne tiltager over dage til uger med en typisk varighed på under 1 måned. Oftest ses forværring af dyspnø (hos 100% af patienterne), forværring af hoste (ca. 50-80%), ekspektoration (ca. 50-60%) og feber (ca. 25%).
1.5.2. Kliniske fund
Som regel ses takypnø og hypoxæmi samt behov for ekstra ilttilskud. Værdien af stetoskopi er begrænset, fordi der ved underliggende IPF kan høres bilateral basal krepitation (såkaldt velkrokrepitation), som kan være svær at skelne fra krepitation ved fx lungeødem eller pneumoni.
1.6. KLINISKE DIFFERENTIALDIAGNOSER
- Pneumoni
- Hastig progression af IPF
- Lungeemboli
- Hjertesvigt med lungeødem
- Arytmi
- Pulmonal hypertension
- Medicinudløst pneumonitis
- Pneumothorax
- Pleuraeffusion
1.7. UDREDNING
Grundprincipperne for udredningen af AE-IPF er:
- HRCT er nødvendig for at kunne stille diagnosen AE-IPF
- Undersøg for evt. udløsende faktorer (se pkt. 1.3 ovenfor)
- Udeluk anden årsag til den respiratoriske forværring (se pkt. 1.6 ovenfor)
1.7.1. Billeddiagnostik
Røntgen thorax og lunge-ultralyd (LUS) kan bruges til at udelukke fx pneumothorax eller pleuraeffusion, men er ikke tilstrækkelige til at bekræfte eller udelukke AE-IPF. Kun hvis tidligere LUS er foretaget på patienten under stabile lungemæssige forhold vil en gentaget undersøgelse kunne indikere evt. forværring af LUS fundene. Se i øvrigt separat DLS retningslinje om LUS.
HRCT er nødvendig for at kunne stille diagnosen AE-IPF. Ved AE-IPF ses nyopståede bilaterale matglasforandringer (hyppigst) og/eller konsolideringer (sjældnere) oveni det underliggende UIP-mønster (se figur 1).
Efter HRCT foretages ofte CT thorax med i.v. kontrast (alternativt SPECT/CT) for at udelukke lungeemboli.
Ved mistanke om AE-IPF kan man ikke undlade HRCT og kun tage en CT thorax med i.v. kontrast, idet kontrastindgift vanskeliggør vurdering af lungeparenkymet.
1.7.2. Blodprøver
Ingen blodprøver er diagnostiske for AE-IPF men tages mhp. differentialdiagnostik.
Fx kan tages CRP, leukocytter med differentialtælling, procalcitonin, D-dimer, koronarmarkører og pro-BNP.
Akutte fasereaktanter er dog ofte forhøjede og kan derfor ikke bruges til sikkert at skelne mellem AE-IPF og fx infektion eller lungeemboli.
1.7.3. Mikrobiologi
Bloddyrkning og nedre luftvejssekret (ekspektorat eller trakealsug) til D+R inkl. undersøgelse for atypiske bakterier samt luftvejsvira tages fra alle patienter. Ofte undersøges også for opportunistisk infektion, som fx pneumocyster.
1.7.4. Øvrige undersøgelser
Ekkokardiografi kan være relevant til at påvise hjertesvigt eller indikere pulmonal hypertension. Bronkoskopi med mikrobiologisk BAL kan overvejes i udvalgte tilfælde, men udbyttet er ofte begrænset i forhold til risiko for forværring af tilstanden. Lungebiopsi frarådes grundet høj risiko for død.
1.8. BEHANDLING
Evidensgrundlaget for behandlingsmulighederne ved AE-IPF er sparsomt, ofte baseret på ekspertviden og med variation mellem forskellige hospitaler og lande. Ved tvivl, konfereres patienter med et af landets højt specialiserede ILS-centre, som ofte allerede følger patienten.
1.8.1. Ilttilskud
Ekstra ilttilskud er ofte nødvendigt ved AE-IPF for at opretholde en acceptabel saturation, evt. som high-flow ilttilskud. Patienter med IPF kan som regel tåle ilttilskud uden at udvikle hyperkapni, medmindre de samtidig har KOL/emfysem.
1.8.2. Antitrombotisk medicin
Patienter med AE-IPF er i øget risiko for dyb venetrombose og lungeemboli, og bør derfor sættes i profylaktisk behandling med lav-molekylært heparin.
1.8.3. Glukokortikoider og immunsuppresiva
Der foreligger ikke bred konsensus omkring farmakologisk behandling af AF-IPF, men internationale guidelines anbefaler som udgangspunkt (svag evidens) glukokortikoider til de fleste patienter med AE-IPF. Der er dog ikke gennemført randomiserede placebo-kontrollerede studier, som undersøger indikation eller dosering af glukokortikoider.
Afhængig af sværhedsgraden af AE-IPF gives glukokortikoid i form af:
- Prednisolon 0,5-1 mg/kg daglig eller
- Methylprednisolon 500-1000 mg i.v. daglig i 3 dage, herefter aftrappet til prednisolon 0,5 mg/kg daglig
Andre immunsuppressiva bliver ikke brugt i behandling af AE-IPF. Tillæg af cyclophosphamid til i.v. methylprednisolon gav i et randomiseret kontrolleret studie øget dødelighed hos patienter med AE-IPF, sammenlignet med højdosis i.v. methylprednisolon alene (3 måneders mortalitet 45% vs. 31%).
1.8.4. Antimikrobiel medicin
Infektion kan være en udløsende årsag til en AE-IPF. Derfor gives som regel antibiotika og evt. antiviral og antifungal behandling på empirisk grundlag indtil PCR- samt dyrknings- og resistenssvar foreligger.
1.8.5. Antifibrotisk medicin
Fast behandling af patienter med IPF med antifibrotisk medicin mindsker risikoen for AE-IPF. Derimod er effekten af opstart af pirfenidon eller nintedanib under en AE-IPF ikke kendt, og individuel vurdering og drøftelse med ILS-center anbefales. Antifibrotisk medicin øger ikke risikoen for infektioner og hvis patienten allerede er i behandling med pirfenidon eller nintedanib, bør denne som regel fortsættes uændret under en AE-IPF.
1.8.6. Mekanisk ventilation
Mekanisk ventilation kan være relevant i udvalgte tilfælde, især hvis der kan påvises en reversibel udløsende årsag til AE-IPF. Beslutningen skal dog holdes op imod en 1-års mortalitet på op til 90% hos respiratorkrævende patienter med IPF.
Få selekterede patienter med AE-IPF kan komme i betragtning til lungetransplantation, og drøftelse med transplantationscenter kan være nødvendig inden man træffer beslutning om mekanisk ventilation. Dette gælder typisk for patienter som er udredt og måske allerede står på venteliste. Se i øvrigt DLS’ retningslinje om lungetransplantation.
1.8.7. Palliation
Palliation skal tænkes ind i alle dele af behandlingen af AE-IPF. Ilt, morfin, inhaleret bronkodilaterende medicin og lindring af andre symptomer (smerter, obstipation, depression, refluks osv.) er væsentlige dele af behandlingen.
Beslutning om behandlingsniveau og behandlingsophør kan blive relevant efter inddragelse af patient og pårørende. Ideelt er der allerede taget stilling til behandlingsniveau ved en ambulant samtale.
Se i øvrigt DLS’ ”Klaringsrapport om palliation til non-malign kronisk lungesygdom”.
1.9. PROGNOSE
Prognosen ved AE-IPF er alvorlig, også med behandling. De præcise estimater for mortalitet afhænger af den undersøgte population, den benyttede definition af AE-IPF og sværhedsgraden.
In-hospital mortalitet trods behandling var henholdsvis 27% og 55% i et fransk og et amerikansk studie. 1-års mortalitet var henholdsvis 65% og 87% i et finsk og et amerikansk studie.
Overlevere oplever ofte klinisk betydende og irreversibel forværring af FVC, DLCO, 6-minutters gangdistance samt livskvalitet.
2 Akut exacerbation af non-IPF interstitiel lungesygdom
Der er beskrevet akutte exacerbationer for de fleste interstitielle lungesygdomme (AE-ILS), fx reumatoid artrit associeret ILS, fibrotisk allergisk alveolitis (hypersensitivitets pneumonitis) og uklassificerbar fibroserende ILS, med en estimeret 1-års mortalitet på 33-100%, afhængig af den underliggende interstitielle lungesygdom.
Ofte bruges de samme kriterier for AE-ILS som for AE-IPF (se ovenfor), herunder kriteriet om allerede kendt eller mistænkt underliggende fibrotisk ILS.
Der foreligger ingen randomiserede kontrollerede studier som angiver, hvordan AE-ILS bedst håndteres. Der bruges ofte den samme udredning og behandling som for AE-IPF med stort fokus på udelukkelse af differentialdiagnoser (herunder medicinudløst pneumonitis, hvor seponering af det udløsende agens og behandling med glukokortikoid kan være livreddende) samt understøttende og pallierende behandling (se pkt. 1.7 og 1.8 ovenfor).
Behandlingen af AE-ILS er kompleks, da der ofte er behov for en individualiseret tilgang for de forskellige ILS. Fx kan der ved autoimmune ILS, med primært inflammatorisk patologi, lægges større vægt på immunsuppresiva, og for systemisk sklerodermi-associeret ILS udvises forsigtighed med høje doser glukokortikoid pga. risiko for udvikling af malign hypertension og renal krise.
Patienter med AE-ILS bør derfor konfereres med et af landets højt specialiserede ILS-centre.
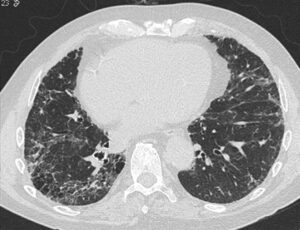
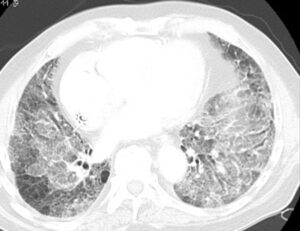
Figur 1: HRCT fra en patient med IPF (venstre), og fra den samme patient under en AE-IPF (højre) med udtalte bilaterale matglasforandringer oveni den kendte lungefibrose
2.0. REFERENCER
Collard Harold R, Ryerson Christopher J, Corte Tamera J, et al. Acute exacerbation of idiopathic pulmonary fibrosis an international working group report. Am. J. Respir. Crit. Care Med. 2016; 194: 265–275.
Collard Harold R, Yow Eric, Richeldi Luca, et al. Suspected acute exacerbation of idiopathic pulmonary fibrosis as an outcome measure in clinical trials. Respir. Res. Respiratory Research; 2013; 14: 1
Kreuter, M., Polke, M., Walsh, S. L. F, et al (2020). Acute exacerbation of idiopathic pulmonary fibrosis: International survey and call for harmonisation. European Respiratory Journal, 55 (4)
Kolb Martin, Bondue Benjamin, Pesci Alberto, et al. Acute exacerbations of progressive-fibrosing interstitial lung diseases. Eur. Respir. Rev. 2018; 27: 1–8
Naccache Jean Marc, Jouneau Stéphane, Didier Morgane, et al. Cyclophosphamide added to glucocorticoids in acute exacerbation of idiopathic pulmonary fibrosis (EXAFIP): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Respir. Med. 2022; 10: 26–34.
Petnak Tananchai, Lertjitbanjong Ploypin, Thongprayoon Charat, et al. Impact of Antifibrotic Therapy on Mortality and Acute Exacerbation in Idiopathic Pulmonary Fibrosis: A Systematic Review and Meta-Analysis. Chest. Elsevier Inc; 2021; 160: 1751–1763