1.1 AFGRÆNSNING
Denne retningslinje dækker primær diagnostik og behandling af samfundserhvervet pleurainfektion hos voksne (≥ 18 år). Kirurgisk behandling og håndtering af patienter med svigt af standard behandling er omtalt i separat vejledning fra Dansk Thoraxkirurgisk Selskab (3).
1.1 DEFINITIONER
Pleurainfektion: inficeret pleuravæske som omfatter simpel, kompliceret parapneumonisk effusion og pleuraempyem (tabel 1)
Parapneumonisk effusion: non-purulent pleuravæske associeret med pneumoni.
Pleuraempyem: makroskopisk pus eller mikroskopisk påvisning af bakterie eller bakteriel vækst i pleuravæske.
Kompliceret parapneumonisk effusion: non-purulent pleuravæske med metaboliske tegn til infektion.
1.2 INTRODUKTION
Omtrent 700 patienter/år behandles for pleurainfektion i Danmark. Både internationalt og i Danmark er incidensen af pleurainfektion stigende.Pleurainfektion er en potentielt livstruende og invaliderende sygdom med 3-måneders mortalitet på ca. 25% og 1-års mortalitet på op til 35% især hos ældre og multimorbide patienter (1,2).
1.3 VARETAGELSE AF BEHANDLING AF PATIENTER MED PLEURAINFEKTION
Alle akutte modtageafdelinger skal kunne varetage initial diagnostik og behandling af patienter med mulig infektion i pleurahulen med aspiration og analyse af pleuravæske og anlæggelse af pleuradrænage da tidlig diagnose og behandling er afgørende for at sikre godt outcome. Videre behandling varetages af lungemedicinsk afdeling i samarbejde med lokale mikrobiolog og thoraxkirurgiske afdeling. Omkring 5-22% behøver thoraxkirurgisk intervention (4).
1.4 RISIKOFAKTORER
Disponerende faktorer er øget pneumonirisiko, fremmedlegemer/procedurer og nedsat immunrespons: diabetes mellitus, immundefekt, bakteriæmi, malignitet, levercirrose, bronkieektasier, kronisk nyresvigt, gastro-oesophageal refluks, tunnelleret pleuradræn (indwelling pleural catheter, IPC), thoraxoperationer, CNS-sygdomme (aspirationsrisiko), dårlig tandstatus og alkohol- eller i.v. misbrug (1).
1.5 PATOFYSIOLOGI
Pleura kan inficeres direkte (f.eks. ved pneumoni med pleurakontakt) eller via defekt i thoraxvæg (f.eks. IPC eller gennem diafragma ved abdominal infektion), bronkiesystem (f.eks. bronkopleural fistel efter operation) eller hulorgan (f.eks. oesofagusruptur). Pleura kan også inficeres ved hæmatogen eller lymfogen spredning fra både torakale og ekstratorakale infektioner.
Den hyppigste mekanisme er sekundær kolonisering af inflammatorisk udløst pleuravæske (simpel parapneumonisk effusion), som derfor indgår i stadieinddelingen af pleurainfektion. Tabel 1 viser de forskellige stadier, og hvorledes de adskilles bed-side ved diagnostisk aspiration af pleuravæske med inspektion (klar/skyet/grumset/purulent) og måling af pH. Se også https://www.lungemedicin.dk/ pleuraeffusion/. Pleuravæske sendes til biokemi, cytologi og dyrkning/mikroskopi både i spidsglas og bloddyrknings kolber.
Tabel 1. Stadieinddeling, radiologi, behandling og indikation for drænage af pleurainfektion (*angiver afgørende diagnostiske punkter for behandlingsvalg). Stadie-udvikling er et kontinuum, og det er vigtigt at flere parameter tyder i det samme stadie-retning.
|
Stadie |
Typisk udseende |
Typisk Pleuravæske-analyse |
Billeddiagnostisk fund Se DLS retningslinje omhandler lunge ultralydsskanning https://lungemedicin.dk/fokuseret-lungeultralydskanning/ |
Behandling |
| I: Simpel parapneumonisk effusion | Klar | pH ≥7,40
LDH <900 IU/l Glukose >4,0 mmol/l Leukocytose (polynukleære): få Dyrkning/mikroskopi: neg. |
UL: Oftest lille effusion uden septae eller lokuleringer (lommer)
CT: Pleura effusion evt. med kontrast opladning i pleura. Uden lokuleringer eller lommer
|
Antibiotika (i.v. eller p.o.)
Stor effusion: Overvej drænage |
| Overgangstadie mellem I og II | Klar/skyet | pH 7,21 til 7,39*
LDH ≤ eller≥900 IU/l Leukocytose (polynukleære) Glukose ≥eller≤4.0 mml/l |
Kunne variere i radiologisk fund mellem stadie I og II | Intravenøs antibiotika
Dræn anlægges hvis flere parametre i pleuravæske analyse eller radiologi tyder i retning af stadie II (LDH≥900 IU/l, eller glukose ≤4)
|
| II: Kompliceret parapneumonisk effusion | Klar/skyet | pH ≤7,20*
LDH ≥900 IU/l Glukose <3,3mmol/l Leukocytose (polynukleære)
|
UL: effusion med fibrintråde og begyndende septae dannelse.
CT: en eller flere af: kontrast opladning i pleura, pleuraspilt sign, septae , lokuleringer (lommer) luftbobler i pleuravæsken. |
Intravenøs antibiotika Pleuradræn og intrapleural behandling
|
| III: Pleuraempyem | Pus/grum-set* | – pH måles ikke
– LDH ≥900 IU/l – Glukose <3,3mmol/l -leukocytose (polynukleære) -Dyrkning/mikroskopi: pos./neg. |
UL: Pleuravæsken kan ligge som én stor ansamling med eller uden septae eller i multiple lommer (lokulering)
CT: En eller flere af følgende: kontrast opladning i pleura, pleuraspilt sign, evt septae , lokuleringer eller luftbobler i pleuravæsken |
Pleuravæske-pH måles i A-gassprøjte og analyseres med det samme i ABL-maskine.
OBS: pH er muligt falsk høj ved Proteus mirabilis/vulgaris-infektion og falsk lav ved blodacidose f.eks. sepsis. Glukose er muligt falsk høj ved hyperglykæmi og falsk lav ved acidose.
1.6 MORTALITET OG RAPID SCORE
Mortalitetsrisikoen kan initialt prognosticeres ved RAPID-score (tabel 2) hvor karbamid, alder, purulens af pleuravæske, serumalbumin og hvorvidt samfundserhvervet eller Hospitalserhvervet infektion bidrager til en risikoscore for død- (1,4,13,14). RAPID-score er ikke undersøgt mhp. behandlingstiltag fx kirurgisk indgreb, fibrinolyse etc.), men kan give et fingerpeg om sygdommens alvor og anbefales beregnet hos alle patienter der er indlagt med pleurainfektion.
Tabel 2: RAPID score med henblik på 3-måneders mortalitets risiko: lav- (1.5%), mellem- (18%) og højrisiko (48%).

1.7 MIKROBIOLOGI
På grund af bl.a. forudgående antibiotika-behandling er pleuravæskedyrkninger blot positive i cirka 20- 50% af tilfældene ved det kliniske og parakliniske billede foreneligt med pleurainfektion. Der foreligger kun enkelte nyere studier af mikrobiologisk ætiologi i Danmark eller Skandinavien (6). Det nedenfor anførte er derfor især baseret på flere studier fra England, Sverige og Danmark af samfundserhvervet pleurainfektion: Spektret af bakterier udgøres af streptokokker (50%), Staphylococcus aureus (10- 20%), gram negative bakterier (10-20%, oftest E. coli), samt anaerobe bakterier (20-30%) (6,7). Flere studier med nukleinsyre-analyse af pleuravæske indikerer dog, at anaerobe bakterier forekommer væsentligt hyppigere (op til 80%). Blandingsinfektioner er ofte påvist (hos ca. 30%) (1,6,7). De såkaldte atypiske patogener (Legionella pneumophila, Mycoplasma pneumoniae, Chlamydia pneumoniae, Chlamydia psittaci) kan medføre simpel parapneumonisk effusion, men sjældent pleurainfektion.
Hospitalserhvervet pleurainfektion: skyldes oftere S. aureus (35%; især i udlandet en stor andel af MRSA), eller Gram-negative bakterier (35%; E. coli, Enterobacter spp, Pseudomonas aeruginosa, Klebsiella spp), men også anaerobe bakterier (10%) og streptokokker (10-18%) forekommer.
I Danmark er pleurainfektion pga. tuberkulose, gær- eller skimmelsvamp sjælden.
1.8 KLINISK MISTANKE OM MULIG INFEKTION I PLEURAHULEN
Alle patienter, der indlægges med pleuraeffusion af ukendt årsag, bør mistænkes for at have mulig infektion i pleurahulen og skal subakut have foretaget diagnostisk pleuracentese. Patienter med pneumoni uden tilfredsstillende respons på antibiotisk behandling indenfor 2-3 dage bør vurderes med fornyet billeddiagnostik med henblik på mulig tilkomst af betydelig pleuravæske eller lungeabsces.
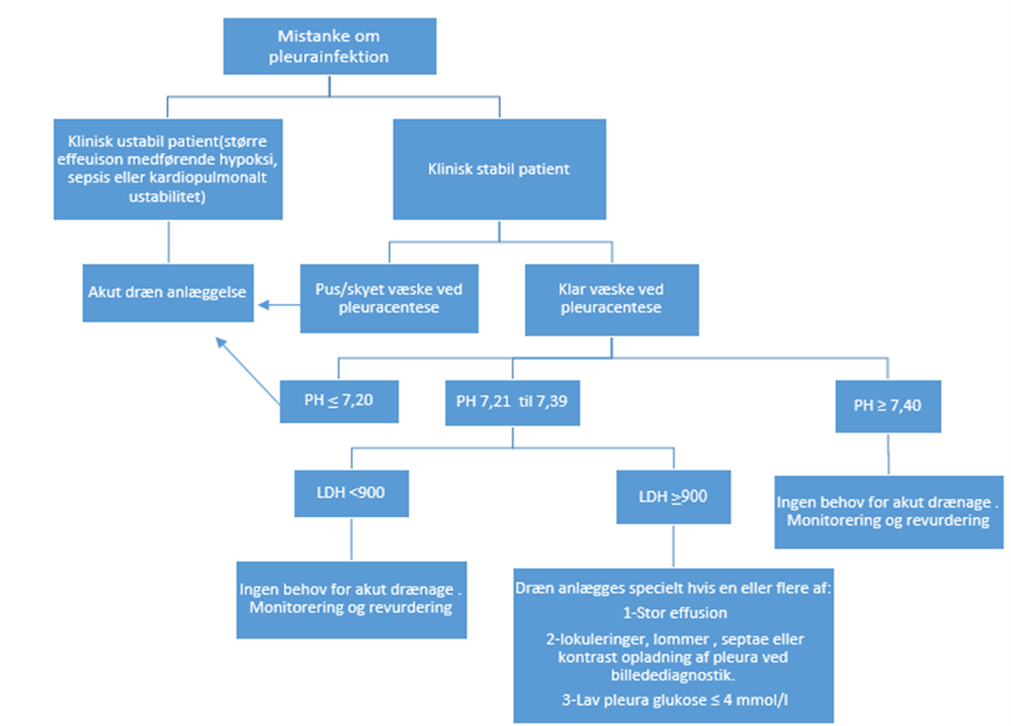
Figur 1. Initial diagnostik og behandling af patienter med pleuraeffusion og klinisk mistanke om infektion.
1.9 INITIALE TILGANG NÅR MISTANKEN ER REJST
Patienter med pleuraeffusion og mistanke om pleurainfektion bør udredes akut:
1.9.1 Akut basis diagnostik inkluderer røntgen af thorax, blodprøver (evt. A-gas), EKG, gennemdyrkning (blod, luftvejssekret, pleuravæske – sendes i spidsglas og en anaerob og en aerob dyrkningskolbe [6-8ml/kolbe]), pleuravæske biokemi, lungeultralydskanning. Overvej mikrobiologisk analyse af bakteriel nukleinsyre (16S PCR), hvis der allerede er givet >1 døgns antibiotika. I sjældne tilfælde kan pleurabiopsi overvejes som sendes til dyrkning. Det er ikke muligt med radiologi alene sikkert at skelne imellem simpel parapneumonisk effusion, kompliceret parapneumonisk effusion eller empyem. Det kræver pleurapunktur og pleuravæske-analyse.
1.9.2 Lungeultralydskanning (LUS) er røntgen af thorax overlegent til diagnostik af pleuraeffusion. LUS må derfor anses som værende en standard undersøgelse hos patienter med mistænkt pleural infektion. LUS er CT overlegent i forhold til at bedømme grad af lokulering og septadannelse i pleuraeffusioner, men kan ikke identificere lokaliserede væskelommer som ikke er subpleuralt placeret (f.eks. langs mediastinum, interlobulært ) eller er placeret bag større knoglestrukturer (f.eks. scapula). Med LUS kan man danne sig et præcist billede af effusionens omfang, septae- og lokulering, belyse fund der indikerer differentialdiagnoser (malign pleuraeffusion, større konsolidering fremfor effusion, lungeabsces, displaceret diafragma), graduere og typebestemme den underliggende lungekonsolidering. LUS kan senere i forløbet anvendes til monitorering (f.eks. identifikation af ikke-drænerede restansamlinger, verificere sufficient udtømt ansamling inden drænseponering, identificere komplicerende pneumothorax, pleurodese eller udvikling af non-expandable lung). Udover den diagnostiske værdi har LUS en central rolle i forhold til at identificere
optimale sted for pleurapunktur / drænplacering samt at foretage de pleurale procedurer ultralydsvejledt.
1.9.3 Pleuracentese er afgørende for korrekt diagnose og behandlingsvalg. Det er vigtigt at pleuracentesen foretages før antibiotisk behandling startes – hvis muligt. Størrelse og placeringen af effusionen bedømmes med LUS og afgør, hvorvidt der kan foretages diagnostisk punktur, eller om der skal anlægges pleuradræn (1.10.2) og desuden tages væske til diagnostik. Pleurabiopsi øger graden af diagnostisk positivt resultat (især ved tuberkulose eller malignitet). Pleurabiopsi er forbeholdt billeddiagnostiske, thoraxkirurgiske eller specialiserede lungemedicinske afdelinger.
1.10 BEHANDLING
1.10.1 Antibiotikabehandling startes ideelt set efter diagnostisk pleuracentese, men en væsentlig forsinket behandlingsstart øger risikoen for død og komplikationer. Derfor må behandlingsstart ikke forsinkes unødigt, hvis pleuracentesen ikke kan gennemføres straks.
Valget af empirisk behandling bør følge regionale kliniske mikrobiologiske retningslinjer og tilrettes de efterfølgende fund (6,7) og gerne i samråd med kliniske mikrobiologiske afdeling. Der tilrådes i alt 4-6 ugers antibiotikabehandling mhp. et klinisk effektivt resultat og for at minimere recidiv.
Empirisk initiale behandlingsanbefaling kan variere i mindre grad afhængig af regional instruks: Cefuroxim 1,5 g x 3 i.v. kombineret med Metronidazol 500 mg x 3 i.v./p.o. eller Penicillin 2 MIE x 4 i.v. i kombination med Metronidazol 500 mg x 3 i.v./p.o. eller monoterapi med Clindamycin 600 mg x 3 i.v. ved penicillin/betalaktamallergi. Ved hospitalserhvervet pleurainfektion, da gerne Ceftriaxon 2 g x 1 i.v. eller Moxifloxacin 400 mg x 1 i.v. Intravenøs behandling gives indtil klinisk respons (feberfrihed, bedring af almen tilstand, CRP-fald) samt bedring billeddiagnostisk og biokemisk, typisk efter de første 5-14 dage. Forlænges oftest ved insufficient klinisk respons.
Den efterfølgende konsoliderende p.o. antibiotikabehandling: enten empirisk (dvs. ukendt ætiologi) konsoliderende regime: Amoxicillin 500–1000 mg/Clavulansyre 125 mg stk. x 3-4 p.o. kombineret med Metronidazol 500 mg x 3 p.o., eller Clindamycin 600 mg x 3 p.o.
1.10.2 Drænbehandling er en afgørende del af behandlingen af pleurainfektion. Drænage har til formål at tømme inficeret væske fra pleurahulen og etablere adgang til pleurahulen mhp. evt. installation af intrapleural behandling (se 1.10.3). Drænage bør ske hurtigst muligt hvis indiceret uafhængigt af antibiotika behandling.
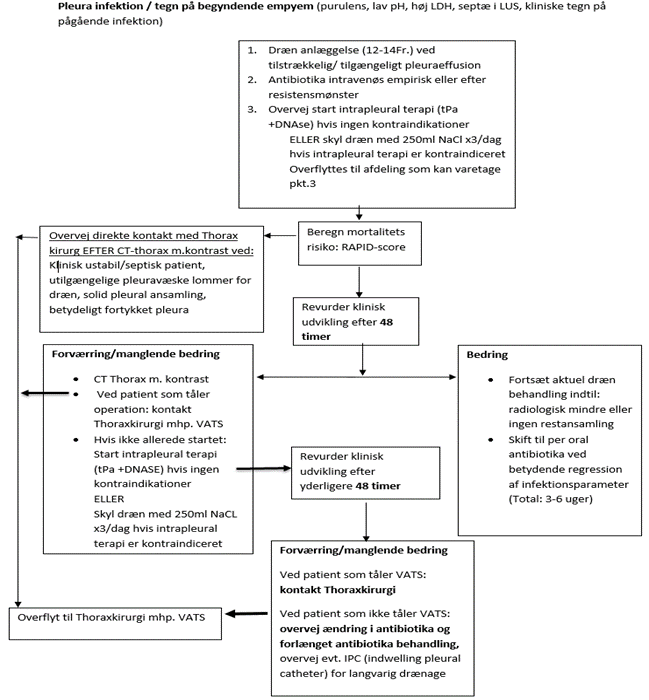
Figur 2. Vejledning til initiering af pleuradrænage ved mistanke om pleurainfektion (4).
Ved verificeret pleurainfektion: (se figur 1 og 2 ) Pleuradræn anlægges ultralydsvejledt ved det optimale anlæggelsessted for at reducere risiko for komplikationer (blødning, pneumothorax, og skade til andre organer). Der anbefales pigtail-kateter minimum 12-14 Fr., da mindre dræn kan medføre ukomplet drænage pga. okklusion med pus eller fibrin. Ved septae-dannelse anlægges pigtail-kateter i den største tilgængelig lomme. Skylning af dræn foretages 2-3 gange dagligt med minimum 20 mL isoton NaCl for at sikre åbenstående dræn.
Skylning med større mængde isoton NaCl, f.eks. 250 mL x 3 dagligt, kan foretrækkes og foretages især ved manglende mulighed for etablering af intrapleural terapi eller kontraindikation hertil.
Seponering af dræn: Pragmatisk kan følgende anvendes: Klinisk og paraklinisk bedring, og billeddiagnostik uden betydende resteffusion, klar drænskyllevæske uden pus med minimal sediment dannelse /fibrin i drænposesystemet; samt dræn-volumen produktion <200 ml/døgn. Der er ingen solid evidens for, hvornår dræn bedst kan seponeres.
1.10.3 Intrapleural behandling: Intrapleural behandling varetages af lungemedicinske og thoraxkirurgiske afdelinger. Der bruges typisk en kombination af Alteplase (tPa) og DNAse. Installationen af lægemidlerne gives oftest forskudt med 1-2 timer, men kan også gives konkomitant for at mindske drænplejetid. Der er ingen evidens for at den ene metode er superior over for den anden, da der mangler direkte sammenligning i større studier. Men der er nogen evidens for at konkomitant applikation af alteplase/DNAse er effektivt og uden større risiko for komplikationer sammenlignet med forskudt applikation (1,4).
Behandling gives oftest 2 gange dagligt i typisk 3 dage dvs. i alt 6 doser, med mindst 8 timers mellemrum (se appendiks 1 for tilberedelse og applikation). Behandling kan forlænges ved insufficient resultat og efter konference med lungemedicinsk specialafdeling.
Forinden sikres korrekt drænplacering ved røntgen af thorax. Derefter skylles (med f.eks. 20 mL NaCl) før applikation af intrapleural terapi (ingen sivning af skyllevæske fra indstiksstedet og ingen saltvandssmag i munden som kunne være et tegn for fistel til bronkietræet). Herved minimeres komplikationer til behandlingen.
Relative kontraindikationer til intrapleural terapi er: 1) nylig enten større blødning, trauma, kirurgisk intervention eller apoplexi, 2) kendt allergi mod en af indholdsstofferne, 3) luftproduktion i drænet (mistanke om bronkopleural fistel), 4) pågående blodfortyndende behandling.
1.10.4 Billediagnostik: Radiologisk monitorering med røntgen af thorax eller LUS. CT af thorax med kontrast anvendes rutinemæssigt, men især hvis drænet ikke virker efter forventningerne, ved mistanke om anden underliggende patologi i lungen (tumor, bronkieobstruktion, fremmedlegeme eller lungeabsces) eller ved mistanke om behandlingssvigt. Ventetid på udførelse af initiale CT af thorax må ikke forsinke primær behandling med antibiotika og dræn.
1.10.5 Tromboseprofylakse og AK-behandling: Patienter med pleurainfektion har en højere risiko for at udvikle venøse tromber. Derfor bør patienter som ikke i forvejen modtager DOAK/AK behandling påbegynde profylaktisk lav-molekylært heparin og så snart som muligt mobiliseres på afdeling, evt. med hjælp af fysioterapi.
Der skal overvejes om patienter i DOAK/AK behandling evt. skal have denne pauseret og skiftet til LMWH, især hvis der kan blive tale om evt. re-intervention eller intrapleural terapi pga. mindre risiko for blødning.
1.10.6 Ernæring: Dårlig ernæring og hypoalbuminæmi er associeret med et dårligere outcome. Det bør sikres, at patienten får sufficient ernæring; om nødvendigt med anlæggelse af ernæringssonde eller parenteral ernæring med hjælp af en diætist.
1.10.7 Fysioterapi: I tilfælde af en kombination af pleurainfektion og pneumoni, hvor der er problemer med sekretstagnation i luftvejene, er det en fordele at involvere lungefysioterapeut mhp. sekret mobilisering.
1.11 VURDERING AF RESPONS
1.11.1 Systematisk vurdering af behandlingsrespons i 48 timers interval er nødvendigt efter iværksat primær behandling (se figur 2). Ved godt respons fastholdes behandling med fornyet revurdering efter yderligere 48 timer. Vurderes der ikke at være sufficient behandlingsrespons ud fra klinik, paraklinik og billeddiagnostik, så rekvireres subakut CT af thorax med kontrast og tages kontakt til thoraxkirurg mhp. muligt behov for thoraxkirurgisk intervention (efter behandlingstrin med drænskyl, 1.10.2 – og intrapleural terapi, 1.10.3). Dette er med henblik på at tilstræbe operation relevant tidligt i forløbet (efter 5-7 dage ved svigt af standardbehandling) (3).
1.11.2 Thoraxkirurgisk assistance: Kontakt mhp. thoraxkirurgisk vurdering og assistance forgår typisk via lungemedicinere, men lokale arbejdsgange kan afvige fra dette princip. Inden konference med en thoraxkirurgisk afdeling bør der foreligge nylig CT af thorax med kontrast (maks. 3 dage gammel).
Indikation for kirurgisk behandling mhp. at opnå infektionskontrol er en eller flere af følgende:
1) manglende klinisk fremgang trods rette antibiotika og understøttende behandling og manglende sufficient pleuradrænage trods flere dræn, skylning og intrapleural terapi.
2) inficerede pleuralommer som ligger utilgængeligt for pleuradrænage.
3) sepsis trods flere dræn, skylning og intrapleural terapi.
Operation foretages som regel som kikkertoperation (Video-assisted thoracoscopy, VATS). Principperne for operation er drænage, frigørelse af lungen (delokulering), debridement med henblik at få lungen foldet så godt ud som muligt. Der kan være områder af lungen som ikke kan frigøres uden for stor skade på lungen.
VATS-decorticatio udføres med relativ lav morbiditet (15%), og mortalitet (3,1%) på alle fire danske thoraxkirurgiske centre, og indlæggelses-varighed er cirka 7 dage (17). Konvertering til åben operation kan være nødvendig men øger indlæggelsesvarighed, morbiditet og mortalitet (17)(23).
1.11.3 Forskning:
Der udføres aktuelt i Danmark et nationalt studie ”Drænage og fibrinolytikum versus tidlig operation hos patienter med pleurainfektion – et nationalt, randomiseret, kontrolleret multicenter-studie” mhp. at afklare om tidlig kirurgi er aktuelle behandlingsregime overlegent mhp. indlæggelsesvarighed, infektionskontrol og langtids-outcomes. Afdelinger fra alle danske regioner deltager. Forespørgsler vedrørende projektet kan rettes til projektstyregruppen
(10.1136/bmjopen-2021-054236).
1.12 OPFØLGNING
Ved udskrivelsen af patienter efter behandling af pleurainfektion skal patienten instrueres i at søge læge ved tegn på recidiv dvs. feber, åndenød, thoraxsmerter, eller forværret almentilstand. Afhængig af det kliniske forløb bør der foretages ambulant kontrol ca. 4 uger efter udskrivelsen ved den lokale lungemedicinske afdeling. Flere kontrolbesøg kan være relevante for udvalgte patienter hvor risiko af recidiv er stor (f.eks. større restansamling ved overgang til peroral behandling og udskrivelse). Undersøgelser ved ambulant besøg vil typisk være: Klinisk vurdering samt infektionstal, røntgen af thorax og evt. LUS og CT-thorax samt lungefunktionsundersøgelse.
1.13 PROGNOSE
1-års-mortaliteten efter pleurainfektion anslås at være 20% og stigende mod 35% hos ældre, komorbide og immunsupprimerede patienter (1), se også afsnit 1.6. Over 15% af patienterne udvikler sequelae (i en dansk opgørelse var tallet dog 37%, men heri indregnes også klinisk ubetydende radiologiske fund). Sequelae ses hyppigst ved empyem og omfatter pleurafortykkelse, pleuraforkalkning, respiratorisk begrænsning og meget sjældent fisteldannelse eller non-expandable lung. Ved rettidig og kompetent diagnostik og behandling medfører den pleurale forandring sjældent en varig funktionsnedsættelse. Risikofaktorer for øget mortalitet er følgende: insufficient initial antibiotikabehandling, forsinket drænbehandling, manglende initiering af intrapleural terapi, samt behov for thoraxkirurgi til infektionskontrol.
1.14 REFERENCER
- Bedawi EO, Ricciardi S, Hassan M, Gooseman MR, et al . ERS/ESTS statement on the management of pleural infection in adults. Eur Respir J. 2023 Feb 2;61(2):2201062. doi: 10.1183/13993003.01062-2022. PMID: 36229045.
- Bodtger U, Hallifax RJ. Epidemiology: why is pleural disease becoming more common? In: Maskell NA, Laursen CB, Lee YCG, et al., eds. Pleural Disease (ERS Monograph). Sheffield, European Respiratory Society, 2020; pp. 1–12 [https://doi.org/10.1183/2312508X.10022819].
- Christensen TD, Bach P, Neckelmann K, Viby NE, Laursen CB. Empyem behandlingsvejledning. Dansk Thoraxkirurgisk Selskab. LINK til instruks: https://thoraxkirurgi.dk/nbv/pleuraempyem/
- Roberts ME, Rahman NM, Maskell NA On behalf of the BTS Pleural Guideline Development Group, et al British Thoracic Society Guideline for pleural disease. Thorax 2023;78:s1-s42. dx.doi.org/10.1136/thorax-2022-219784
- Søgaard M, Nielsen RB, Nørgaard M, Kornum JB, Schønheyder HC, Thomsen RW. Incidence, Length of Stay, and Prognosis of Hospitalized Patients with Pleural Empyema. Chest. 2014;145(1):189-192. doi:10.1378/chest.13- 1912
- Meyer CN, Rosenlund S, Nielsen J, Friis-Møller A. Bacteriological aetiology and antimicrobial treatment of pleural empyema. Scand J Infect Dis. 2011;43(3):165-169. doi:10.3109/00365548.2010.536162
- Dyrhovden R, Nygaard RM, Patal R, Ulvestad E, Kommedal Ø. The bacterial aetiology of pleural empyema. A descriptive and comparative metagenomic study. Clin Mikrobio Inf. 2019 Aug;25(8):981-986. doi: 10.1016/j.cmi.2018.11.030.
- Rahman NM, Maskell NA, Davies CWH, et al. The relationship between chest tube size and clinical outcome in pleural infection. Chest. 2010;137(3):536-543. doi:10.1378/chest.09- 1044
- Meyer CN, Armbruster K, Kemp M, Thomsen TR, Dessau RB. Pleural infection: a retrospective study of clinical outcome and the correlation to known etiology, co-morbidity and treatment factors. BMC Pulm Med. 2018;18(1):160. doi:10.1186/s12890-018-0726-1
- Bedawi EO, Rahman NM.Pleural infection: moving from treatment to prevention.ERS Monograph Pleural Disease, Chapter 10, 2020. ISBN: 978-1-84984-115-3
- Hooper CE, Edey AJ. Pleural irrigation trial (PIT): a randomised controlled trial of pleural irrigation with normal saline versus standard care in patients with pleural infection.Eur Respir J 2015;46:456-463
- Altmann ES, Crossingham I. Intra-pleural fibrinolytic therapy versus placebo, or different fibrinolytic agent, in the treatment of adult parapneumonic effusions and empyema. Cochrane Database of Systematic Reviews 2019, Issue
- Art.No.:CD002312 10. White HD, Henry C, Predicting Longterm Outcomes in Pleural Infections. RAPID score for risk stratification Ann Am Thorac Soc. 2015 Sep;12(9):1310-6.
- Rahman NM, Brennan CK, A clinical score (RAPID) to identify those at risk for poor outcome at presentation in patients with pleural infection, Chest 2014 Apr; 145 (4) 848- 855
- Corcoran JP, Psallidas L. Prospective validation of the RAPID clinical risk prediction score in adult patients with pleural infection: the PILOT study. Eur Respir.J.2020 Nov 26; 56 (5):2000130.
Appendix 1 Tilberedelse og applikation af intrapleural terapi (1)
Intrapleural terapi med 1) Actilyse (Alteplase) 10 mg og 2) DNAse (Pulmozyme) 5 mg.
| Tilberedning af Actilyse: Opløsning af 10 mg Actilyse i medfølgende 10 ml solvens i 50 ml sprøjteà fortyndes blandingen med isoton NaCl til i alt 30 ml. |
| Tilberedning af DNAse (Pulmozyme): Foregår ved at 5 ml Pulmozyme 1 mg/ml væske (dvs. 2 plastikbeholdere) trækkes op i en 50 ml sprøjteà fortyndes blandingen med isoton NaCl til i alt 30 ml. |
| Konkomitant applikation:
|
Forskudt applikation |
| Tilberedt Actilyse appliceres via pleuradrænet àskylning med 10 ml isoton NaCl àappliceres tilberedt DNAse à skylning med 10 ml isoton NaCl àdræn lukkes og åbnes igen efter en time.
|
Tilberedt Actilyse appliceres via pleuradrænet à skylning med 20 ml isoton NaCl à dræn lukkes og åbnes efter 1 time àafvent en time med åbent dræn à appliceres tilberedt DNAse à skylning med 20 ml isoton NaCl àdræn lukkes og åbnes først efter en time.
|