DEFINITION
Allergisk alveolitis (AA) eller hypersensitivitetspneumonitis (HP) er en inflammatorisk og/eller fibrotisk sygdom, der afficerer lungeparenkymet og de små luftveje. AA skyldes typisk en immunmedieret reaktion provokeret ved inhalation af et kendt eller okkult antigen hos modtagelige individer.
1.1. FOREKOMST
Et dansk registerstudie har fundet en AA incidens på 1,16/100.000 personer. Hyppigheden af AA er stigende og i et amerikansk studie fandt man en estimeret 1-års prævalens på 1,67 stigende til 2,71/100.000 indbyggere fra 2004 til 2015. Stigningen sås især > 65 år, hvor prævalensen var 11/100.000.
Over 300 forskellige antigener er identificeret som årsag til AA, hvoraf de fleste er case reports, enkeltudbrud og flere nu kun af historisk interesse.
1.2. PATOGENESE
AA repræsenterer en immunologisk reaktion på et inhaleret antigen. Patogenesen er kompleks og kun delvist belyst, men involverer både immunkompleks medieret (type III) og T-celle-medieret (type IV) reaktioner hos genetisk disponerede personer. Immunkompleks reaktionen har den betydning at serum præcipiterende antistoffer mod det udløsende antigen kan demonstreres i blodet.
AA dækker over mange forskellige eksponeringer og kliniske præsentationer. Forekomsten varierer betydeligt mellem klimazoner, erhverv og arbejdsmetoder, f.eks. i landbruget. Patienter med AA har været udsat for gentagen inhalation af aerosoler/støv som f.eks. fuglestøv, dampe eller gasser, hvori de egentlige antigener befinder sig. Dette kan være bakterier, svampe, parasitter, dyre- eller plante-proteinstoffer, typisk organiske men nogle gange uorganiske kemikalier.
De hyppigste og bedst undersøgte former for AA er fugleholderlunge, hvis årsag både kan skyldes fækale og fjerrelaterede proteiner. Tidligere var tærskerlunge hyppig, hvor bakterien Saccharopolyspora rectivirgula er en af de vigtigste patogener inden for Thermophilic actinomycetes slægten, men med ændrede landbrugsmetoder er forekomsten faldet betydeligt.
AA kan skyldes skimmelsvampeantigener fra fugtigt træ f.eks. hos savværksarbejdere, arbejde med flis til opvarmning, skimmelvækst i bl.a. vandskadede bygninger, jacuzzi, sauna m.v. Ofte navngives tilstanden iht. eksponeringen (Tabel 1).
En oversigt over forskellig eksponering og antigener kan findes på www.hplung.com.
Tabel 1. Eksempler på årsager til allergisk alveolitis
| Sygdom | Kilde til antigenet | Ætiologi
(vigtigste antigen) |
| Tærskerlunge | Fugtigt hø | Thermophile actinomyces |
| Fugleholderlunge | Fæces og fjer | Diverse proteiner
|
| Dueholderlunge
Kartoffelavlerlunge |
Fæces og fjer
Skimmelsvamp |
Diverse proteiner
Thermophile actinomyces, aspergillus sp. |
|
Dyrepasserlunge |
Rottepels |
Rotteurin
|
| Befugterlunge |
Kontamineret aircondition |
Thermophile actinomyces, penicillium m.m. |
|
Hot tub lunge |
Jacuzzi |
Mycobacterium avium |
|
Maskinarbejder- Lunge |
Kølesmøre-midler |
Mycobacterium sp., Gram-negative Bakterier |
|
Metalarbejder-lunge |
Hårdmetal bearbejdning |
Kobolt |
Rygning eller virkningerne heraf har betydning for forekomsten af AA, idet AA oftere ses hos ikke-rygere end hos rygere, mens rygere med AA ofte har et alvorligere forløb end ikke-rygere med AA.
1.3. UDREDNING
AA klassificeres klinisk efter tilstedeværelse af inflammation og/eller fibrose på HRCT og/eller histopatologi som non-fibrotisk eller fibrotisk AA. Patienter med blandet morfologi karakteriseres baseret på den dominerende morfologi. Forekomst af fibrose er dog oftest bestemmende for behandlingsrespons og prognose.
Fibrotisk AA kan være meget svær at skelne fra andre former for fibrotisk interstitiel lungesygdom.
Det kliniske billede er broget, men detaljeret anamnese, symptomatologi, objektive fund inkl. diverse paraklinik samt multidisciplinær team diskussion med tilstedeværelse af lungemedicinere, radiologer, patologer og arbejdsmedicinere kan føre til mere præcis diagnostik.
Eksponering
Meget væsentligt er nøje oplysning om eksponering (f.eks. hønsehold, duer, volierefugle, landbrugspartikler, foderstoffer, træfældning m.m.), udluftningsforhold, synlig fugt/skimmelsvamp og opmærksomhed på evt. medicin, ligesom opmærksomhed på varighed og debut af symptomer også er væsentlig i relation til ekspoenring.
Symptomer
Der er stor symptomvariation ved non-fibrotisk og fibrotisk AA afhængig af intensitet og frekvens af eksponering for det årsagsgivende antigen. Der er et betydeligt overlap mellem fænotyperne.
Non-fibrotisk AA
Er typisk karakteriseret ved debut timer til få dage efter korttids/intermitterende eksponering med udvikling af feber, hoste, dyspnø, og vedvarende (uger) influenzalignende sygdomsfornemmelse. Symptomerne kan bedres væsentligt mellem eksponeringsperioderne. Ved fortsat eksponering kan hosten blive produktiv, åndenøden permanent og almentilstanden permanent nedsat.
Fibrotisk AA
Er typisk karakteriseret ved længere (måneder-år) sygdomsvarighed. Fremtrædende symptomer er ofte hoste, snigende dyspnø, træthed og vægttab. Rapportering af tidligere akutte og subakutte episoder vil ofte være en hjælp til at identificere tilstanden, men kan helt mangle i sygehistorien. Akut exacerbation af fibrotisk AA kan ses og har et alvorligt forløb med høj mortalitet (se DLS retningslinje ”Akut exacerbation af IPF og andre interstitielle lungesygdomme”).
1.3.1 Objektive fund
Objektive fund er sparsomme og uspecifikke med takypnø og tør, fin krepitation eller sjældnere inspiratoriske rhonchi (eng. squeaks) ved lungestetoskopi. Ved svær AA ses hyppigt desaturation ved aktivitet eller hypoxæmi uden at dette fund er specifikt for selve sygdommen. I fremskredne tilfælde kan ses trommestikfingre, cyanose og højresidigt hjertesvigt.
1.3.2 Paraklinik
Parakliniske værdier er sjældent af diagnostisk værdi for AA, men bør udføres i differentialdiagnostisk øjemed. Ved akut indsættende sygdom er de hyppigste fund leukocytose, forhøjet CRP, IgG, SR samt LDH.
Måling af specifikke IgG-antistoffer er kun indiceret, hvis der er velbegrundet mistanke om, at en eksponering for relevante allergener kan have udløst AA. IgG-antistoffer er ikke ensbetydende med sygdom, men indikerer eksponering for det pågældende antigen. Mange asymptomatiske personer kan have forhøjede værdier af specifikke IgG-antistoffer i blodet uden nogensinde at udvikle AA. Der er fortsat en række ubesvarede spørgsmål vedrørende validering af tests specifikke IgG
Flertallet af patienter har restriktiv lungefunktionsnedsættelse med nedsat diffusion. Blandet restriktivt og obstruktivt mønster kan ses, mens et rent obstruktivt mønster er sjældent.
RU thorax kan ved non-fibrotisk AA være normalt, men klassisk ses diffus øget lungetæthed med bilaterale diffuse mikronoduli basalt og perihilært.
Ved fibrotisk AA ses bilaterale fibroseforandringer.
HRCT har en betydelig højere sensitivitet for AA end konventionel RU thorax, og bør altid udføres også hvor RU thorax er normalt og diagnosen AA fortsat mistænkes. Normal HRCT udelukker dog ikke non-fibrotisk AA med kortvarig eksponering og resolution af inflammationen.
Nye kriterier for HRCT inddeler fundene i typisk, forenelig med eller ubestemt for AA.
Non-fibrotisk AA
Den typiske HRCT viser diffus matglastegning med involvering af alle lungeafsnit med enkelte sparede lobuli, mosaikattenuering, centrilobulære mikronoduli og air trapping (figur 1). Forandringerne er ofte reversible ved ophør af eksponering og med evt. steroidbehandling.
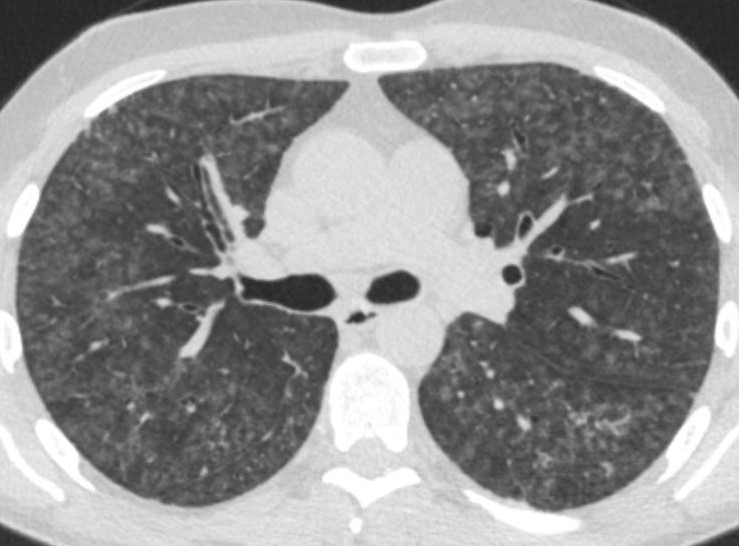
Figur 1. HRCT ved non-fibrotisk allergisk alveolitis.
Fibrotisk AA
HRCT ved Fibrotisk AA inddeles ligeledes i ”typisk”, ”forenelig med” eller ”ubestemt” for fibrotisk AA. Ved den typiske fibrotiske AA ses retikulering, traktionsbronkiektasier og evt. bikagetegning primært i de mellemste lungeafsnit, men sygdommen kan også involvere de basale lungeafsnit. Samtidig ses tegn på small airways disease med centrilobulære noduli, mosaikattenuering og air trapping (figur 2). Fund af ”three-density-sign”, dvs. samtidig forekomst af matglastegning (øget attenuation), normalt lungevæv (normal attenuation) og mosaikattenuering (nedsat attenuation) er patognomonisk for fibrotisk AA. Tilstedeværelse af fibrose er forbundet med en dårligere prognose.
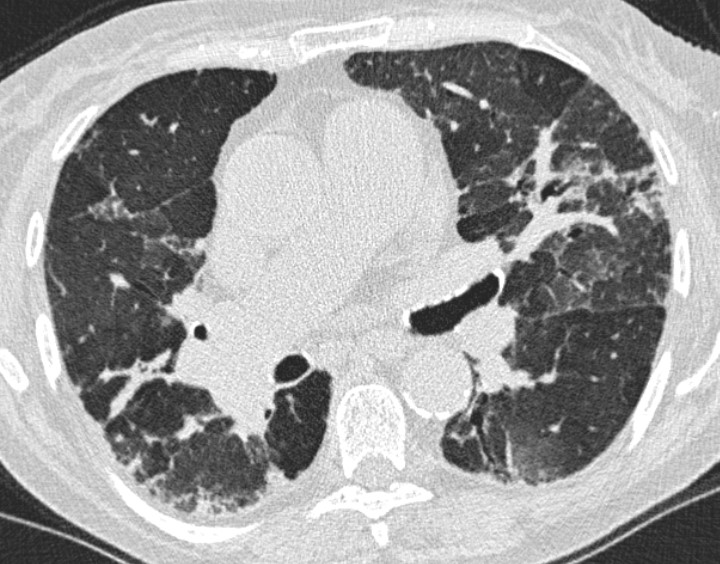
Figur 2. HRCT ved fibrotisk allergisk alveolitis.
Ved bronkoalveolær lavage (BAL) findes typisk lymfocytær inflammation (lymfocytter 20-70%) og lav CD4/CD8 ratio ved non-fibrotisk AA, hvorimod der kan være normal BAL ved fibrotisk AA.
Man kan ofte opnå tilstrækkelig og repræsentativ histopatologi ved transbronkiale tang- eller cryobiopsier ved AA, men kirurgisk biopsi kan være nødvendige ved fibrotisk AA. Det histopatologiske mønster inddeles i ”typisk”, ”forenelig med” og ”indeterminate”, hvor fund af bronkiolocentrisk inflammation, lymfocytær inflammation og løstformede non-nekrotiserende granulomer er klassiske fund ved den non-fibrotiske AA (figur 3). Der kan ses områder med organiserende pneumoni (OP) og non-specifik interstitiel pneumonitis (NSIP) foruden fibroseforandringer ved den fibrotiske AA. Fibrotiske forandringer viser sig typisk ved arkitektonisk distorsion, fibroblastfoci og bikagetegning, samt luftvejscentreret interstitiel fibrose.
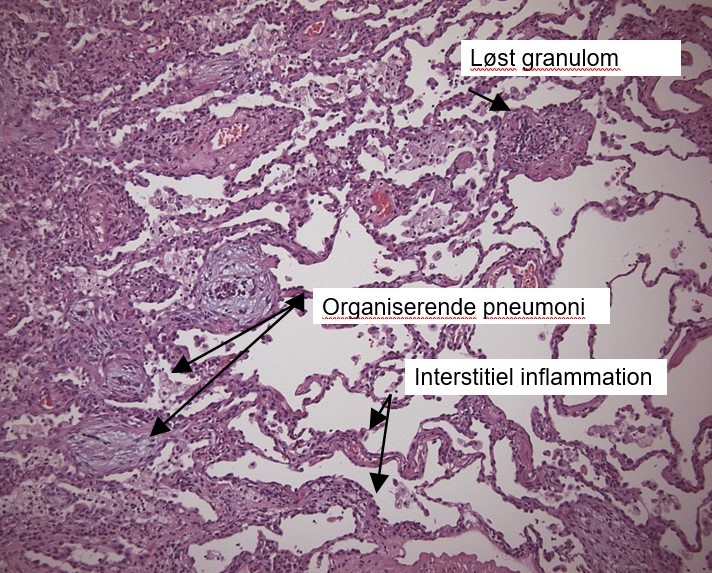
Figur 3: Typiske histologiske forandringer hos en pt. med non-fibrotisk AA (Patologisk institut; OUH)
Tilstedeværelse af fibrose er forbundet med en dårligere prognose. Jo mere fibrotisk det histopatologiske mønster er, jo dårligere prognose (OP > NSIP > UIP).
1.4. DIAGNOSE
Hurtig og korrekt diagnose er vigtig idet sygdommen ved debut er potentielt reversibel, mens en udiagnosticeret og ubehandlet AA kan medføre varig lungeskade.
Grundlaget for at mistænke AA er det kliniske billede og radiologi som beskrevet i foregående afsnit.
Diagnosen baseres på grundig anamnese med fokus på eksponering både vedrørende erhvervs-, fritids- og beboelsesforhold herunder evt. fugle/dyr. Herudover afklares brug af lægemidler. Henvisning til arbejds- og miljømedicinsk afdeling anbefales ved mistanke om erhvervseksponering eller ukendt agens.
Det afgørende i diagnostikken er herefter at afklare om der er fund ved den objektive undersøgelse, som styrker mistanken om AA og at HRCT-thorax er foreneligt med AA.
Mistanken om AA kan om muligt styrkes ved påvisning af specifikke IgG-antistoffer mod det mistænkte antigen. I 30-50% af tilfældene, og især ved fibrotisk AA, identificeres intet antigen eller specifikke IgG-antistoffer.
Især ved den non-fibrotiske form kan et diagnostisk værktøj være en mulig fjernelse af patienten fra det potentielt skadelige miljø (fx fjernelse fra arbejdspladsen eller hjemmet ved mistænkt eksponering) og observation af effekten af dette tiltag.
En undersøgelse (fx en byggeteknisk gennemgang) på det formodede ekspositionssted med påvisning af velkendt antigen kan sandsynliggøre en sammenhæng. Provokationstest kan udføres som overvåget re-eksponering i patientens miljø, fx på arbejdspladsen men benyttes sjældent i praksis pga. bekymring for mulig forværring af tilstanden.
Ved diagnostisk usikkerhed overfor anden interstitiel lungesygdom er bronkoskopi med BAL, evt. TBB/TBCB, og i særlige tilfælde kirurgisk lungebiopsi indiceret.
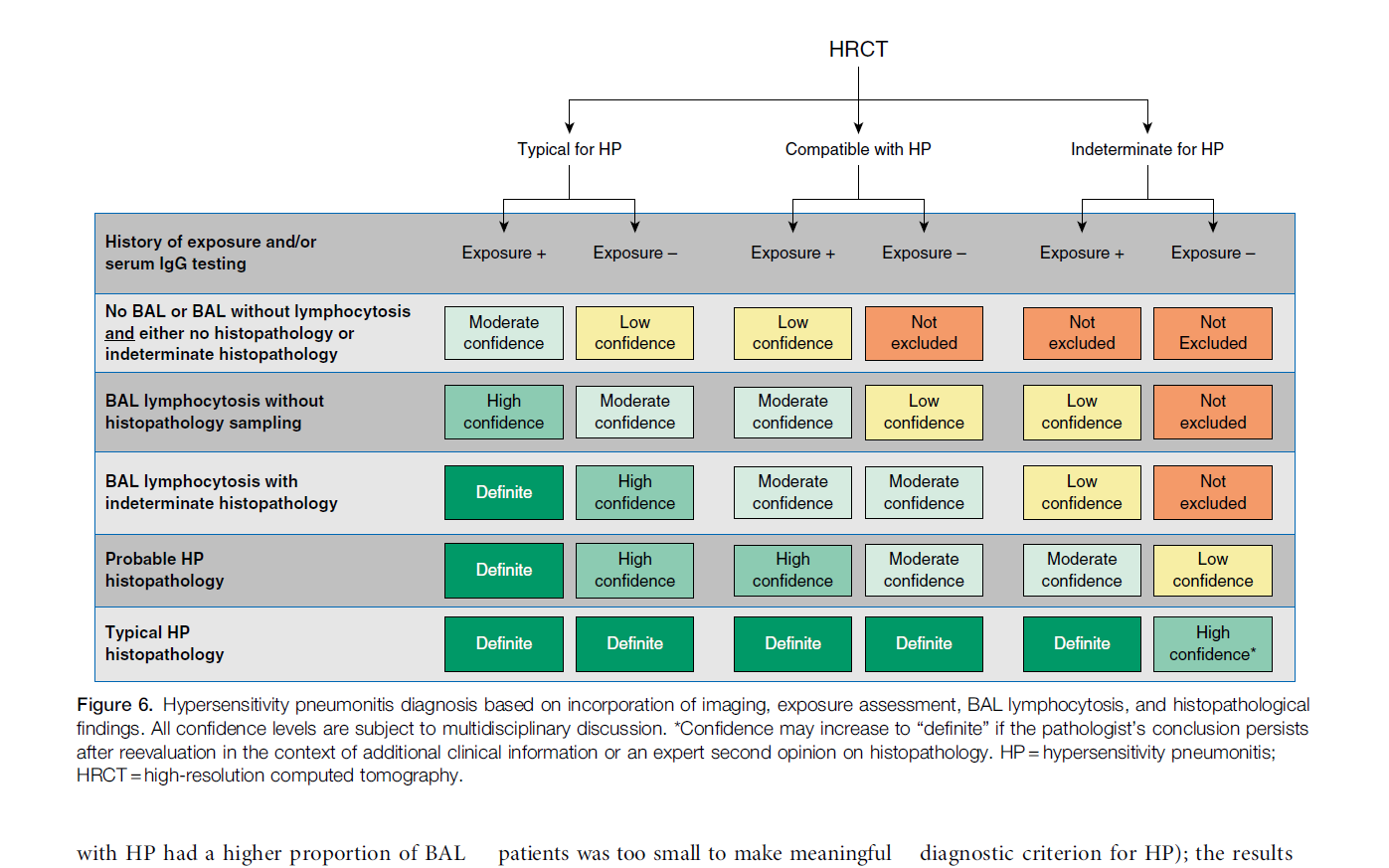
Hvor mange undersøgelser af de nævnte, der skal gennemføres ved den enkelte patient afhænger af patientens risikoprofil og hvor sikker en diagnose, der ønskes (Se figur 4 nederst i retningslinjen).
Generelt bør der altid foreligge:
- Information om erkendt årsag/antigen
- Udelukkelse af anden form for interstitiel lungesygdom
- Typiske fund på HRCT
Disse undersøgelser kan suppleres med:
- BAL med lymfocytose (>30% for ikke eller ex-rygere og > 20% for rygere); CD4/CD8 < 1.3
- Transbronkial eller kirurgisk lungebiopsi tydende på AA
- Evt. specifikke IgG antistoffer relevante for sygehistorien.
- Svind af symptomer ved fjernelse af patienten fra ekspositionen (eller evt. positiv provokationstest/re-eksposi-tion i patientens miljø).
1.5. DIFFERENTIALDIAGNOSE
Ved akut præsentation kan non-fibrotisk AA forveksles med influenza og pneumoni. Øvrige differentialdiagnoser omfatter Organic Toxic Dust Syndrome (OTDS) og Inhalation fever, hvor der ikke er en immunologisk reaktion.
Ved den længerevarende non-fibrotiske eller fibrotiske AA, hvor hovedsymptomerne er dyspnø, hoste og træthed kan sygdommen forveksles med KOL, astma eller andre interstitielle lungesygdomme som fx IPF, eller sarkoidose.
1.6. BEHANDLING
Tidlig diagnose og eliminering af antigen eksponering er de væsentligste elementer i behandlingen. Bortskaffelse af fugle, eller grundig undersøgelse af boligen og arbejdspladsen med efterfølgende sanering af evt. koloniserede bygninger eller anlæg kan være en sufficient intervention hos nogle patienter. Hvis antigenet ikke kan identificeres eller eliminering af eksponeringen er umuligt at gennemføre i praksis, kan det blive nødvendigt at fjerne patienten fra det miljø, hvor eksponering forekommer. Dette kan have alvorlige sociale og økonomiske konsekvenser og bør overvejes nøje i samråd med arbejdsmediciner og de sociale myndigheder.
Ved non-fibrotisk AA er der evidens for, at behandling med steroid accelererer reduktion af symptomer, men uden at ændre den langsigtede prognose sammenlignet med placebo. Behandlingen bør derfor primært vælges til patienter med nedsat lungefunktion samt betydelige symptomer, som forringer livskvaliteten. Den optimale dosis og længde af behandlingen er uvis. Oftest startes med tbl. prednisolon (0,5-1 mg/kg dagligt) i 1-2 uger og herefter nedtrappes efter klinisk respons og lungefunktion samtidig med effektiv eliminering af det udløsende antigen. Der foreslås en samlet behandlingsvarighed på 3-12 måneder.
Ved fibrotisk AA gælder tilsvarende at elimination af det udløsende antigen har stor positiv betydning for prognosen. Ved kombineret inflammation og fibrose forsøges ofte kombinationsbehandling med prednisolon og/eller steroid-besparende immunsuppression med azathioprin eller mycophenolat mofetil, som vurderes at have ligeværdig effekt. Der foreligger ingen randomiserede undersøgelser.
Ved progression af symptomer, fald i lungefunktion og tiltagende radiologiske forandringer trods standardbehandling (antigen elimination, immunomodulation) som udtryk for progressiv pulmonal fibrose (PPF) kan antifibrotisk behandling med nintedanib (og ved uholdbare bivirkninger pirfenidon) nedsætte progression af fibrosen.
Effekten af inhalationssteroid er ikke belyst, men kan forsøges evt. i kombination med LABA hos patienter med generende hoste og effekten revurderes efter 2-3 måneder.
Patienter med nedsat lungefunktion (FVC<80% eller DLCO<40%), signifikant fald i lungefunktionen (10% fald i FVC eller 15% fald i DLCO over 6 mdr.), hvilehypoksæmi eller pulmonal hypertension skal vurderes mhp. lungetransplantation såfremt der ikke er kontraindikationer herfor.
Optimal palliation inkl. iltbehandling, lungerehabilitering og symptomlindrende medicin bør tilbydes alle patienter.
Behandling af AA er en opgave for de højtspecialiserede lungemedicinske afdelinger.
1.7. PROGNOSE
Risikofaktorer for dårlig prognose er alene belyst i retrospektive studier og omfatter bl.a. tilstedeværelse af fibrose, manglende identifikation af antigen, demografi, og genetiske faktorer (tabel 2).
Tabel 2. Risikofaktorer for dårlig prognose
| Patient-relaterede |
| Alder |
| Mandligt køn |
| Genvarianter i telomerkomplekset
Samtidig forekomst af autoimmun sygdom |
|
Eksponering |
| Uidentificeret eksponering
Langvarig eksponering Højintens eksponering |
| Rygeanamnese |
|
Kliniske |
| Lav lungefunktion (FVC, DLCO)
Desaturation ved aktivitet Radiologisk fibrose (bikagetegning, UIP) Histologisk fibrose Pulmonal hypertension |
1.8. EFTERBEHANDLING OG KONTROL
Valg af kontrol ved AA afhænger af klinisk præsentation, intensitet og progression af sygdommen. Ideelt bør patienter med non-fibrotisk AA kontrolleres indtil helbredelse eller indtil stabilitet uden medicinsk behandling. Ved kontrol vurderes graden af respiratoriske symptomer, dynamisk spirometri og måling af diffusionskapaciteten samt evt. 6 minutters gangtest. Rutine kontrol HRCT er ikke indiceret, men bør overvejes ved sygdomsprogression til at vurdere forholdet mellem reversible og irreversible forandringer. En praktisk tilgang er at afslutte patienten ved stabile forhold gennem 1-2 år.
Patienter med fibrotisk AA har ofte behov for langvarig, evt. livslang kontrol pga. behandling med immunmodulerende og/eller antifibrotisk behandling, risiko for kronisk respirationsinsufficiens, pulmonal hypertension og øget mortalitet.
REFERENCER
Raghu G et al. American Thoracic Society, Japanese Respiratory Society, and Associacion Latinoamericana de Torax.
Diagnosis of Hypersensitivity Pneumonitis in Adults: An Official ATS/JRS/ALAT Clinical Practice Guideline. Am J. Resp Crit Care
Med. 2020.
Fernández Pérez ER, Travis WD, Lynch DA. Diagnosis and Evaluation of Hypersensitivity Pneumonitis. Chest 2021;160(2): e97-e156.
Silva CI, Churg A, Müller NL. Hypersen-sitivity pneumonitis: spectrum of high-resolution CT and pathologic findings. Am. J. Roentgenol. 2007;188(2): 334-44.
Kokkarinen JI, Tukiainen HO, Terho EO. Effect of corticosteroid treatment on the recovery of pulmonary function in farmer’s lung. Am. Rev. Respir. Dis. 1992;145(1): 3-5.
Morell F, Roger A, Reyes L, Cruz MJ, Murio C, Muñoz X. Bird fancier’s lung: a series of 86 patients. Medicine (Baltimore). 2008; 87(2): 110-30
Salisbury ML, Myers JL, Belloli EA. Diagnosis and Treatment of Fibrotic Hypersensitivity Pneumonia. Am J Respir Crit Care Med. 2017;196(6):690–699.
Riario Sforza GG, Marinou A. Hypersensitivity pneumonitis: a complex lung disease. Clin Molecular Allergy. 2017;15:6.
Morriset et al. Use of Mycophenolate Mofetil or Azathioprine for the Management of Chronic Hypersensitivity Pneumonitis. Chest 2017.
Flaherty et al. Nintedanib in Progressive Fibrosing Interstitial Lung Diseases. N Engl J Med 2019; 31;381(18):1718-1727.
Figur 4. Diagnostisk algoritme for allergisk alveolitis (Raghu et al. AJRCCM 2020).