Emne: Non-cystisk fibrose bronkiektasier
1.1. DEFINITION OG FOREKOMST
Bronkiektasier er en irreversibel tilstand af abnorm dilatation af luftvejene, sædvanligvis associeret med fortykkelse af mukosa, slimpropper og varierende grader af inflammation. Tilstanden kan være lokal eller udbredt. Den indre diameter af bronkus skal være større end diameteren af tilstødende arterie og der skal være manglende indsnævring af det bronkiale volumen over mere end 2 cm og/eller synlige bronkier mindre end 2 cm fra pleura.
Der findes ikke sikre tal for forekomsten af bronkiektasier, seneste estimat spænder derfor fra 53 til 566 pr 100.000 indbyggere. Grundet udbredning af HRCT stilles diagnosen tidligere i forløbet og hyppigere. Antallet af svære kliniske tilfælde er aftagende. I Danmark var under 2 ud af 100.000 alders standardiserede hospitalsindlæggelser i 2011-2012 på grund af bronkiektasier.
1.2. ÆTIOLOGI
1.2.1. Patologi
Bronkiektasier opstår som følge af en inflammatorisk kaskade. Udviklingen er endnu ikke helt klarlagt, men den er tilsyneladende forårsaget af en neutrofil inflammatorisk kædereaktion med en høj grad af cytokin- og elastaseaktivitet. Dette medfører destruktion af cilier og bronkievæg, nedsat mukociliær drænage og øget mukusproduktion, samt efterfølgende strukturel skade. Lungeparenkymet peribronkialt og distalt for forandringerne kan blive destrueret sekundært til bronkiektasier. Samtidig er det neutrofile bakteriedrab kompromitteret, hvilket øger risikoen for kronisk bakteriel kolonisation.
Traktionsbronkiektasier opstår på baggrund af mekanisk forvridning af luftvejene som følge af fibrose, som medfører dilaterede luftveje. Immunologien er således ikke afficeret på samme vis som ovenfor beskrevet, men på grund af rigiditeten i det omkringliggende lungevæv bliver mukusdrænagen også her kompromitteret.
1.2.2. Patogenese
Bronkiektasier kan udvikles sideløbende med mange forskellige tilstande eller være idiopatiske. Forandringerne ses hyppigt ved cystisk fibrose (CF) og derfor opdeles bronkiektasier ofte i CF- og non-CF bronkiektasier. CF-bronkiekta-sier adresseres ikke i denne instruks.
De hyppigste årsager til non-CF bronkiektasier gennemgås nedenfor.
- Arvelige:
Primær ciliær dyskinesi, Alfa-1-antitrypsin mangel og Polycystisk nyresygdom er associeret med bronkiektasier. Patienterne har ofte samtidig ciliedefekt.
- Ved kongenite malformationer:
Williams-Campbell syndrom. Manglende brusk i luftvejene medfører mekanisk obstruktion og behandlingsresistente infektioner, med udvikling af bronkiektasier til følge.
Yellow-nail syndrome er associeret med bronkiektasier, stort set altid samtidig kronisk sinuitis.
Marfans syndrom er associeret med bronkiektasier. Bronkiektasier opstår med baggrund i patienternes bindevævsdefekt.
- Efter primær infektion med bakterier / virus:
Klebsiella species
Staphylococcus aureus
Mycobacterium tuberculosis kompleks
Mycobacterium spp.
Mycoplasma pneumonia
Bordetella pertussis
Morbillivirus
Influenzavirus
Herpesvirus
Humant immundefekt virus (HIV)
Respiratorisk syncytialvirus
Adenovirus.
- Ved allergisk bronkopulmonal aspergillose
ABPA (allergisk bronkopulmonal aspergillose) kan både forårsage bronkiektasíer og være en komplikation til dem. Patogenesen er muligvis betinget af den immunologiske reaktion i kombination med luftvejsobstruktion på grund af svampehyfer.
- Efter bronkial obstruktion:
Endobronkiale tumorer
Stenose
Tryk fra hilære lymfeknuder
Fremmedlegemeaspiration
Mellemlapssyndromet, en abnorm vinkling af højre mellemlaps segmentbronkus fører til obstruktion.
- Ved immundefekt-tilstande:
CVID (Common variable immune deficiency)
IgG subklasse defekter
- I relation til autoimmune sygdomme:
Rheumatoid artritis (Bronchiectasis Rheumatoid Overlap Syndrome, BROS)
Sjögrens syndrom
Ankyloserende spondylitis
Inflammatorisk tarmsygdom
Mikroskopisk polyangitis
- I relation til andre lungesygdomme:
Astma
Kronisk obstruktiv lungesygdom
Fibrose (ofte traktionsbronkiektasier)
- Idiopatiske bronkiektasier
Udgør cirka 20-40% af alle tilfælde.
1.3. SYMPTOMER OG KLINISKE FUND
1.3.1. Stabil fase
Vedvarende eller hyppige luftvejsinfektioner, kronisk produktiv hoste stedse eller intermitterende muko-purulent. Patienterne har ofte samtidig rhinosinuitis. Hæmoptyse kan forekomme. Respiratorisk piben og pleurale smerter forekommer forholdsvis hyppigt. Ved udbredte bronkiektasier kan vægttab og dyspnø forekomme. Symptomerne kan progrediere til respira-tionsinsufficiens. Op imod 80 % af alle patienter med bronkiektasier er koloniserede med poten-tielt patogene bakterier i stabil fase, hyppigst Hæmophilus influenzae, Streptococcus pneumoniae, Staphylococcus Aureus og Pseudomonas aeruginosa.
1.3.2. Eksacerbationer
En eksacerbation defineres som en forværring af lokale symptomer (hoste, volumen af ekspektorat, ændring i viskositeten af ekspektoratet, mere puslignende ekspektorat, hvæsende vejrtrækning, åndenød og eventuelt hæmoptyse) samt eventuelle systemiske symptomer. En eksacerbation kan skyldes såvel ny infektion som opblussen af kronisk infektion, og der er ikke nødvendigvis påvirkerede infektionsparametre eller feber.
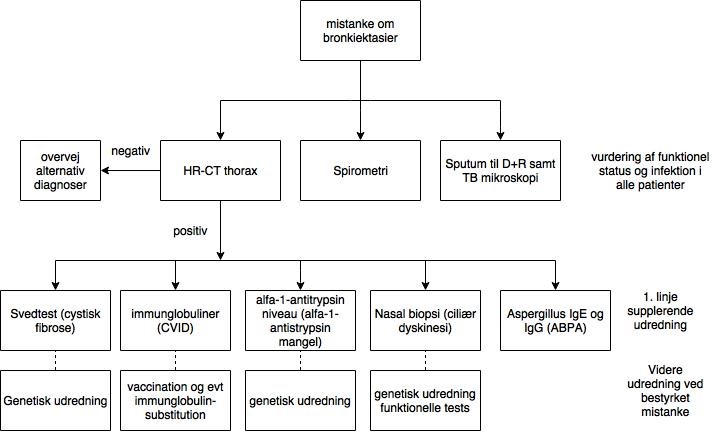
1.4. UDREDNING
Diagnosen bør overvejes hos alle patienter med vedvarende hoste, især hvis den er produktiv og patienter med hyppige nedre luftvejsinfektioner.
1.4.1. Anamnese og klinisk undersøgelse
Familiær disposition, underliggende sygdomme, infektionshyppighed, infektioner i barndommen, antal antibiotikakure per år og reflukssymptomer.
Inspektion bør være med fokus på sameksisterende øvre luftvejssymptomer og eventuelle bindevævslidelser og autoimmune lidelser. Stetoskopi; normale forhold, krepitation, ronchi eller piben. Trommestiksfingre bør altid føre til yderligere udredning.
1.4.2. Paraklinik
Diagnosen stilles baseret på HR-CT.
Oscillometri kan eventuelt anvendes som supplement.
1.4.2.1 Standardudredning
HR-CT scanning af thorax og spirometri (som kan være normal) med reversibilitetstest samt, eventuel bronkial provokationstest. Blodprøver (differentialtælling, CRP, IgA, IgM, IgG og eventuelt Aspergillus titre), dyrkning af ekspektorat samt undersøgelse for mykobakterier og svampe, som typisk kræver særskilt mikrobiologisk rekvisition. Ved samtidig rhinosinuitis bør patienten henvises til øre-næse-halslæge. Ved gastroøsofageal refluks overvejes gastroskopi.
1.4.2.2 Yderligere udredning
Udvidet LFU, blodprøver i henhold til mistænkt grundmorbus, eventuelt CT af bihuler eller bronkoskopi med BAL.
1.4.3. Billeddiagnostik
HR-CT stiller diagnosen jævnfør definitionen.
1.4.4. Prioritering af udredningsforløb
I forhold til prioritering af udredning henvises til Flow-chart på Figur 1, jævnfør ERS monografi.
1.5. BEHANDLING
Den vigtigste opgave er at forhindre forværring. Såfremt en tilgrundliggende sygdom kan identificeres, skal behandlingen følge relevante retningslinjer i denne sammenhæng.
1.5.1.
1.5.2. Forebyggende behandling
- Fysisk træning er essentiel.
- Profylaktisk azithromycin
- Inhaleret antibiotika: f.eks. tobramycin eller promixin
- Patienter som er aktive rygere bør informeres om vigtigheden af rygestop og motiveres til henvisning til rygestopbehandling.
- Influenza vaccine årligt, pneumokok-vaccine med ca. 5 års interval og SARS-CoV-2 vaccination svarende til anbefalede algoritme for sårbare patienter.
- Mukolytica: Der er ikke sikker effekt af hverken orale mukolytika eller inhalerede mukolytika, men de kan bruges såfremt patienten vurderes at have effekt heraf. Mannitol inhalationer har slimløsende effekt, men der er bivirkninger såsom bronkospasme, som kan være meget generende for patienten.
- Nogle oplever god effekt af PEP-fløjte, men evidensen herfor er sparsom.
- LABA/SABA behandling kun ved relevant lungemedicinsk komorbiditet og eventuelt inden fysioterapi eller inhalations antibiotika for at optimere effekten af disse.
- Inhalationssteroid anbefales ved relevant lungemedicinsk komorbiditet eller inflammatorisk tarmsygdom.
- God hånd- og mundhygiejne kan nok være anbefalelsesværdigt, om end der ikke er evidens herfor.
1.5.3. Andre behandlingsforslag
- Kirurgi anvendes sjældent og primært ved helt lokaliseret sygdom. Lungetransplantation kan i sjældne tilfælde komme på tale. Ved hyppig hæmoptyse kan overvejes embolisering.
- Rekombinant DNAse (Pulmozyme) bør ikke bruges hos patienter med bronkiektasier uden cystisk fibrose.
1.5.4. Profylaktisk antibiotisk behandling
Langtidsbehandling med antibiotika anbefales ikke som rutine, men hos udvalgte patienter i speciallægeambulatorium (tre eller flere exacerbationer per år eller øget morbiditet) kan profylaktisk antibiotika overvejes.
- Makrolider; eksempelvis Azithromycin 250-500 mg x 1 mandag, onsdag og fredag hver uge, kan anvendes i denne sammenhæng.
Inden opstart bør der undersøges for non-tuberkuløse mykobakterier ved ekspektorat/BL. Desuden kan det overvejes at foretaget EKG, levertal og høretest, da QTc forlængelse, leverpåvirkning og høretab kan være bivirkninger til behandlingen.
Langtidsbehandling med antibiotika hos patienter med infektion med Pseudomonas aeruginosa er der begrænset evidens for, og behandlingen skal konfereres med lokale mikrobiologer og lungemedicinere. Eksempler på regimer:
- Inhalation Colistin (1-2 mio. IE x 2 dgl). Colistin kan bruges allerede fra første exacerbation med Pseudomonas aeruginosa. Der ydes enkelt tilskud til Colistin efter anden eksacerbation.
- Inhalation Tobramycin (300 mg x 2 dagligt i 4 uger, efterfulgt af 4 ugers pause).
- Inhalation Quinsair (Levofloxacin) (240 mg x 2 dagligt i 4 uger, efterfulgt af 4 ugers pause). Kan bruges som alternativ til Tobramycin, såfremt denne fremkalder bronkospasme eller patienten er kendt med svær astma.
- Inhalation Gentamicin (40 mg x 2 dagligt i 3 dage).
1.5.5. Behandling af akut eksacerbation
Antibiotisk behandling gives efter lokal antibiotika instruks samt efter dyrkningsfund i ekspektorat. Empirisk behandling bør altid dække H. influenzae, (amoxacillin, amoxacillin med clavulansyre, eller pondocillin) og behandlingsvarigheden er 14 dage ved brug af ovennævnte præparater. Ved nyopdaget, ikke persisterende infektion med Pseudomonas aeruginosa er den nuværende konsensus at der bør gøres forsøg på eradikation med 14 dages to-stofbehandling inkluderende baktericidt antibiotika, men der er ikke evidens herfor og studier pågår til at undersøge den rette strategi. Empirisk behandling kunne eksempelvis være piperacillin med tazobactam, 4g x 4 samt ciprofloxacin 500-750 mg x 2. Behandling tilrettes efter resistenssvar. Ved manglende effekt kan følges op med måneders behandling med inhalation Colistin / Tobramycin. Der bør følges op med ekspektorat-prøver til at vurdere behandlingsrespons både under og efter behandling. Selvbehandling ved symptomer på eksacerbation er en mulighed, se afsnit 1.6.3. Ved eksacerbationer bør tillige tilstræbes øget drænage ved hjælp af fysioterapi og PEP-fløjte.
1.6. EFTERBEHANDLING OG KONTROL
Der findes ingen evidensbaserede retningslinjer for opfølgningsprogrammer for patienter med bronkiektasier. Nedenstående må derfor ses som et forslag til et kontrolprogram.
1.6.1. Patienter med anden tilgrundliggende sygdom, se venligst afsnit 1.2.
Bør følges i henhold til gældende retningslinjer for disse med særlige hensyn til komplikationer grundet bronkiektasier.
1.6.2. Overordnet strategi
En kombination af planlagte kontroller og symptombetinget kontakt, hvor hyppigheden afhænger af om patienten er i profylaktisk antibiotisk behandling. Der findes patientadministrerede spørgeskemaer (QOL-B og BHQ) samt et scoringsindeks (BSI) som kan benyttes til at vurdere behov for kontrolhyppighed.
1.6.2.1. Kontroller uden profylaktisk antibiotisk behandling
Årlige planlagte kontroller med
- CRP og leukocytter.
- Ekspektorat til dyrkning og resistens.
- Billeddiagnostiske undersøgelser er ikke nødvendigvis indiceret.
1.6.2.2. Kontroller med profylaktisk antibiotisk behandling
Planlagte kontroller med øget hyppighed under hensyntagen til den enkelte patients behov og morbiditet.
Biokemisk bør undersøgelsesprogrammet tilføjes undersøgelser relateret til bivirkningsprofilen af det valgte profylaktiske antibiotika.
- Spirometri.
- CRP og leukocytter.
- Ekspektorat til dyrkning og resistens.
- Billeddiagnostiske undersøgelser er ikke nødvendigvis indiceret.
- Makrolid: ALAT, LDH, basisk fosfatase, amylase, Na+, K+, kreatinin, CRP, leukocytter, trombocytter og EKG. Ved langtidsbehandling bør foretages audiologisk kontrol, da der er øget risiko for høretab og tinnitus.
- Tobra- og Gentamycin: Hgb, Trombocytter, Leukocytter og differentialtælling, kreatinin og karbamid, ALAT, LDH, basisk fosfatase.
1.6.3. Symptombetinget kontakt
- CRP og leukocytter.
- Ekspektorat til dyrkning og resistens.
- Konventionel røntgen af thorax.
1.6.4 Scoringssystermer:
Der findes flere scoringssystemer, der kan bruges til at vurdere patientens risiko for mortalitet samt morbiditiet. Bronchiectasi Severity Index (BSI) har prædiktionsværdi i forhold til eksacerbationer og er på nuværende tidspunkt det eneste scoringssystem, der er oversat til, og valideret på dansk.
1.7. PROGNOSE
Prognosen for patienter med bronkiektasier varierer, men der er øget morbiditet og mortalitet hos patienter med hyppige eksacerbationer, systemisk inflammation, faldende lungefunktion og persisterende kolonisering med især Hæmophilus Influenzae og Pseudomonas aeruginosa.
REFERENCER:
- ERS monograph, Bronchiectasis, nr. 52, 2011
- Evans DJ, Bara AI, Greenstone M: Prolonged antibiotics for purulent bronchiectasis in children and adults. The Cochrane library 2007: issue 4, 2007.
- Woodhead M, Blasi F Ewig S et al: Guidelines for the management of adult lower respiratory tract infections. Respir. J. 2005; 26: 1138-1180.
- ten Hacken NHT, Wijkstra PJ, Kerstjens HAM: Treatment of bronchiectasis in adults. BMJ 2007; 335: 1089-1093.
- Barker AF: Bronchiectasis. N. Engl. J. Med. 2002; 346 (18): 1383-1393.
- Cole P, Flower CDR, Lavender JP: Clinical and imaging Aspects of Bronchiectasis. 242-252.
- Chalmers JD, Smith MP, McHugh BJ, Doherty C, Govan JR, Hill AT. Short- and Long-Term Antibiotic Treatment Reduces Airway and Systemic Inflammation in Non–Cystic Fibrosis Bronchiectasis. Am J Respir Crit Care Med 2012; 186 (7) 657–665.
- Chalmers JD, Hill AT. Mechanisms of immune dysfunction and bacterial persistence in non-cystic fibrosis bronchiectasis. Molecular immunology. 2013. 55: 27-34.
- Chalmers JD, Aliberti S, Blasi F. State of the art: management of bronchiectasis in adults. Eur. Respir. J. 45 (5): 1446 – 1462.
- Koser U, Hill A: What’s new in the management of adult bronchiectasis? F1000Res. 20 (6): 527.
- Tarrant BJ, Le Maitre C, Romero L, Steward R, Button BM, Thompson BR, Holland AE. Mucoactive agents for chronic, non-cystic fibrosis lung disease: A systematic review and meta-analysis. 2017. 22 (6): 1084-1092.
- Haworth CS, Foweraker JE, Wilkinson P, Kenyon RF, Bilton D. Inhaled colistin in patients with bronchietasis and chronic Pseudomonas aeruginosa 2014. Am J Respir Crit Care Med. 189(8):975-82.
- National Institute for Health and Care Excellence. Non-cystic fibrosis bronchiectasis: inhaled tobramycin. 2017
- Harbord M, Annese V, Vavricka SR, Allez M, Barreiro-de Acosta M et al. European Crohn’s and Colitis Organisation. 2016. The First European Evidence-based Consensus on Extra-intestinal Manifestations in Inflammatory Bowel Disease. J Crohns Colitis. 2016 Mar;10(3):239-54.
- British Thoracic Society. Definition of exacerbation.
- Polverino E, Goeminne PC, McDonnell MJ, Aliberti S, Marshall SE et al. European Respiratory Society guidelines for the management of adult bronchiectasis. 2017. European Respiratory J, 50;1-23
- Chalmers JD et al. Long-term macrolide antibiotics for the treatment of bronchiectasis in adults: an individual participant data meta-analysis. Lancet Respir Med. 2019 Oct;7(10):845-854.
- Chalmers JD et Chotirmall SH. Bronchiectasis: new therapies and new perspectives. Lancet Respir Med 2018 Sep;6(9):715-726.
- Kofod L et al. Respirationsfysioterapi til patienter med sekretproblemer. Sammenslutning af ledende ergo- og fysioterapeuter. Region Hovedstaden 2018;1-81.
Appendix 1: Forskellige typer af bronkiektasier
Bronkiektasierne kan inddeles i cylindriske, varikøse, eller, mindre hyppigt, cystiske. Forandringerne kan findes i alle lapper og beskrives som diffuse eller unilateralt.
1.4.3.1. Cylindriske bronkiektasier
Billedet af en luftfyldt bronkus og tilstødende kar beskrives ofte som en signetringskonfiguration.
Mukøst udtamponerede bronkier vil derimod ofte fremtræde som noduli (tree-in-bud).
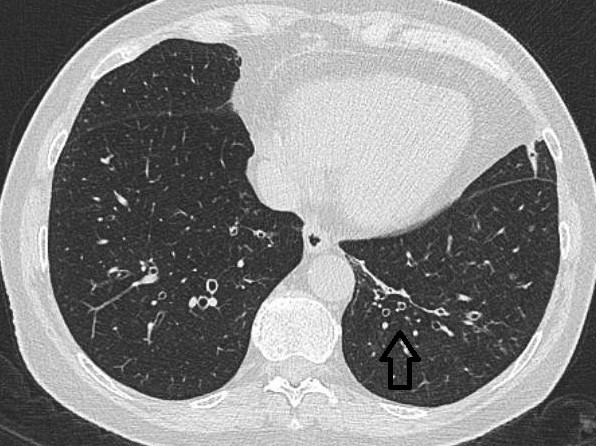
Figur 2: Cylindriske bronkiektasier.
Figur 3: Tree in bud
1.4.3.2. Varikøse bronkiektasier
Varikøse bronkiektasier karakteriseres ved fokale konstriktioner i ellers dilaterede luftveje, og vil derfor billeddiagnostisk kunne fremtræde som perler på en snor. Det kan være svært at skelne varikøse og cylindriske bronkiektasier på tangentielle snit, differentieringen vil ofte afhænge af snitretningen.
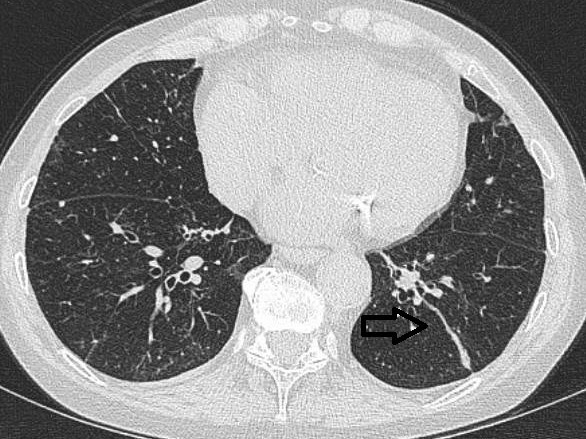
Figur 4: Varikøse bronkiektasier.
1.4.3.3. Cystiske bronkiektasier
Cystiske bronkiektasier fremstår oftest tyndvæggede og luftfyldte men kan være delvist mukusfyldte og derfor have væskespejl. Ofte har de mistet den direkte relation til nærliggende kar. Dette kan give et lidt anderledes billede, hvor øvrige cystiske lungesygdomme må overvejes.
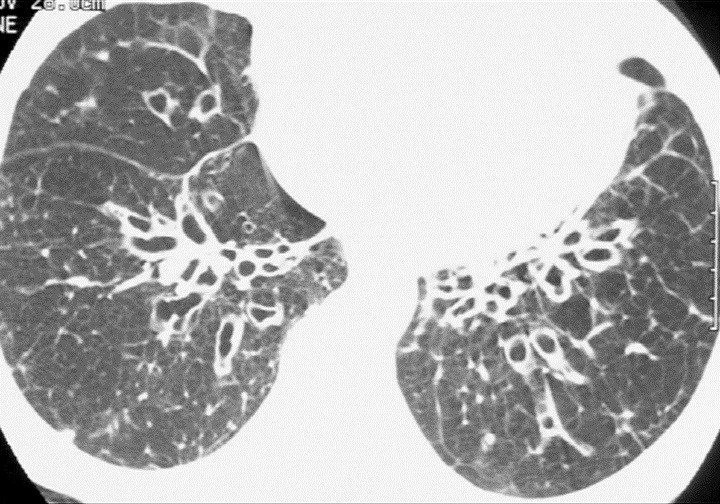
Figur 5a: Cystiske bronkiektasier.
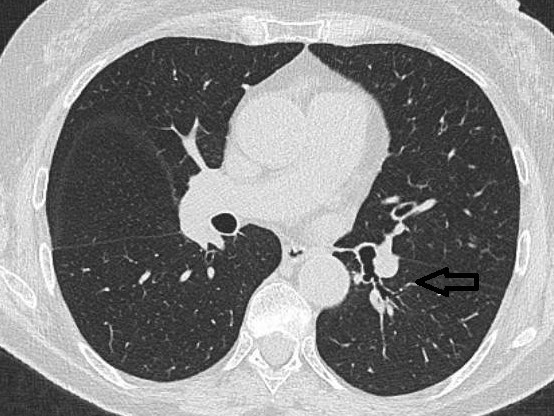
Figur 5b: Sakkulære bronkiektasier
Kronisk inflammation vil forårsage forandringer længere distalt i bronkiesystemet og vil i givet fald kunne ses som bronkiektasier i de ydre 2 cm af lungen.
I sygdommens slutstadier har den inflammatoriske proces ofte forårsaget diffus parenkymatøs forandring af lungevævet, hvilket kan reducere volumen af mellem og underlapper markant, alternativt føre til total lobær atelektase.