1. DEFINITION OG FOREKOMST
Lungekræft er ifølge Kræftens Bekæmpelse den nu mest forekommende kræfttype i Danmark. Sygdommen blev i 2020 diagnosticeret hos omkring 5000 personer i Danmark, og under 30 % overlever 5 år efter diagnosen. Den dårlige overlevelse skyldes alvorligheden af sygdommen i kombination med at diagnosen oftest stilles i fremskreden stadie, hvor helbredelse ikke er mulig. Den nye lungekræftpakke fra 2018 fra Sundhedsstyrelsen har medført, at adgangen til CT-skanninger øges ganske markant i disse år, ikke mindst fordi egen læge nu også kan henvise hertil. Dette medfører, at antallet af fundne lungeinfiltrater, som kræver udredning eller opfølgning, er i hastig stigning.
Udredning af patienter mistænkt for lungekræft foretages ved en række diagnostiske undersøgelser. Lungekræftudredning er udfordrende med stigende krav om udredning af små og perifert beliggende noduli, som identificeres i forbindelse med de stigende antal CT-skanninger, som udføres i disse år. Mange af disse patienter bliver ofte udsat for langvarige og belastende udredningsforløb, da de små forandringer kan være vanskelig at opnå diagnose på ved konventionel bronkoskopi, hvor den diagnostiske sensitivitet for små perifere infiltrater er meget lav. Hvis det ikke lykkes at opnå histopatologisk afklaring, kan det blive nødvendigt, at patienten i stedet henvises til diagnostisk VATS i generel anæstesi for at få stillet diagnosen. Mange patienter kan ikke tåle dette grundet dårlig lungefunktion eller andre konkurrerende sygdomme. Andre diagnostiske modaliteter som røntgen- eller CT-vejledt transtorakal biopsi har høj diagnostisk sensitivitet (op til 88 %), men indebærer også en forholdsvis høj risiko for komplikationer som blødning eller pneumothorax (20-40 %), hvilket som regel medfører efterfølgende indlæggelse og drænbehandling. En sådan komplikation kan være livstruende. Risikoen for livstruende komplikationer er dog meget lav og er relateret til risikoen for fatal blødning eller luftemboli. På centre med høj aktivitet og proceduren holdt på få hænder er mortalitetsrisikoen lav.
Den demografiske udvikling i Danmark vil bevirke, at der i 2030 vil være 430.000 80-årige mod 260.000 i dag (en stigning på 60 %). Disse ældre patienter vil være mere skrøbelige, vil have flere sygdomme og vil have en øget forekomst af lungekræft. Samtidig med at der skannes flere patienter, og der påvises flere forandringer, vil der i fremtiden være et stort behov for at kunne stille en præcis og sikker diagnose for at kunne tilbyde en helbredende behandling. Da dødeligheden for lungekræft er stor, er det fundamentalt vigtigt, at diagnosen stilles så tidligt som muligt, så overlevelsen øges. Desuden er det sandsynligt, at der i fremtiden indføres lungekræftscreening i Danmark, hvilket også vil bevirke, at der vil være et stort behov for at kunne udrede små forandringer i lungerne på en sikker og skånsom måde.
Der er udviklet flere endoskopiske modaliteter, som har til formål at guide bronkoskopøren til de perifere lungeforandringer, således at den diagnostiske sensitivitet kan øges.
2. EPIDEMIOLOGI OG ÆTIOLOGI
Den eksakte incidens af perifere lungenoduli hos den generelle population er ikke kendt. Lungecancer screeningsstudier hos rygere med forhøjet malignitetsrisiko har rapporteret en prævalens på op til 50 %, mens andre CT-studier hos den generelle population har vist en forekomst af incidentale noduli på op til 31 %. Incidensen af påviste lungenoduli ved CT-skanning må formodes at stige i fremtiden grundet de stigende antal CT-skanninger, som udføres hvert år. Nyere generationer af CT-skannere er desuden i stand til at detektere endog meget små lungeforandringer, hvorfor disse forhold samlet set vil medføre et stigende behov for at gøre brug af de endoskopiske modaliteter til at opnå histologisk / cytologisk vævsudtagning fra sådanne forandringer.
En perifer lungenodulus er typisk under 30 mm, og kan opdeles i solid eller subsolid, hvor sidstnævnte atter kan rubriceres som værende enten en matglasnodulus eller delvis solid nodulus (se DLS / DLCG-retningslinje vedr. praktisk håndtering af noduli).
3. ENDOSKOPISKE MODALITETER OG UDREDNING
Der eksisterer flere endoskopiske modaliteter som kan assistere bronkoskopøren til at lokalisere perifere lungeinfiltrater. Ofte er disse modaliteter centraliseret til centre med den nødvendige ekspertise, og kræver den nødvendige oplæring og træning at mestre. Den diagnostiske sensitivitet varierer i studier fra 44-88 %, og afhænger af mange faktorer som størrelse af forandringen, lokalisation og tilstedeværelse af ”bronchus sign” på CT-skanningen, biopsiteknik, lokal ekspertise og ved kombination af flere modaliteter.
Bronkoskopi vejledt af fluoroskopi:
Transbronkiale biopsier foretaget ved fleksibel bronkoskopi, enten som led i malignitetsudredning eller rutinemæssigt til udredning af benigne sygdomme, fx interstitiel lungesygdom, bør altid foregå under vejledning af fluoroskopi (gennemlysning) for at minimere risikoen for blødning og pneumothorax. Ved udredning af perifere infiltrater afhænger lokalisering og biopsitagning af at lungeforandringen er synlig ved fluoroskopi, hvilket typisk vil være solide læsioner over 25 mm. Oftest vil den fluoroskopiske modalitet være kombineret med andre navigationsmetoder (radial EBUS, elektromagnetisk navigationsbronkoskopi ENB).
Bronkoskopi vejledt af CT:
Sammenlignet med konventionel fluoroskopi, kan højopløselig 3D-billeddannende CT-konstruktion i forbindelse med en bronkoskopi give real-time billeder, således at bronkoskopet eller biopsiværktøjer kan guides direkte til læsionen og biopteres under direkte vejledning af CT.
Augmented fluoroskopi:
Augmented fluoroskopi er en ny teknisk real-time modalitet. Systemet kan kobles til et konventionelt fluoroskop, og benytter herefter CT-billeder til at danne en 3D-map med navigationsvej, som kan overlejres det fluoroskopiske image (ligesom virtual reality). Dette danner grundlag for at bronkoskopøren i real-time under vejledning af det forbedrede fluoroskopiske image navigerer ud til den perifere læsion.
Den mest benyttede platform til augmented fluoroskopi er LungVision (Body Vision Medical LTD, Israel).

Før bronkoskopiproceduren overføres patientens CT-skanning til LungVisions planlægningssoftware, således at der kan rekonstrueres et virtuelt trakeobronkialt træ, og læsionen kan markeres og ruten planlægges ud fra både axiale, koronale og sagittale planer. Under proceduren placeres en røntgenfast plade under undersøgelseslejet, som analyserer placeringen af det dedikerede LungVision kateter, som under proceduren føres gennem bronkoskopets arbejdskanal.
De softwarebehandlede CT-billeder med ruten og markeringen af læsionen overføres til LungVision systemet, som er koblet op på den konventionelle C-bue. Herefter genereres et overlejrende fluoroskopisk image med angivelse af læsionen såvel som ruten ovenpå de billeder som det konventionelle fluoroskop danner, og som i real-time guider bronkoskopøren til læsionen. Når kateteret er placeret ud for læsionen, kan placeringen efterfølgende kontrolleres yderligere med fx radial EBUS. Når tumorslagskyggen er konfirmeret, kan der efterfølgende biopteres fra området under real-time vejledning af det forbedrede fluoroskopiske billede, som er i stand til at vise biopsiværktøjet i læsionen, hvorved den diagnostiske sensitivitet øges.
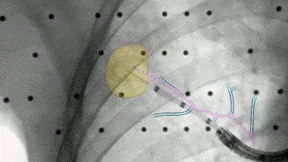
LungVision er en forholdsvis ny modalitet, og foreløbige publicerede studier har vist lovende resultater.
Radial endobronkial ultralyd (EBUS):
Radial EBUS kan benyttes til at lokalisere og vurdere perifere pulmonale læsioner.
Disse såkaldte miniprober fås i forskellige størrelser med en udvendig diameter på 1,4 eller 1,9 mm (Olympus, Tokyo, Japan) eller 1,7 mm (Fujinon, Tokyo, Japan). Den mest almindeligt anvendte ultralydsfrekvens er 20 MHz, som giver høj opløsning og muliggør detaljeret billeddannelse af de indre strukturer af perifere lungelæsioner. Minisonden drives af en ”driving unit”.

Ved brug af en tynd radial ultralydssonde under bronkoskopi, udsendes ultralydsbølger mens sonden roterer (360°), og der opnås et billede af returbølgerne, således at der frembringes et kortakset billede af bronchus og omgivende strukturer. Da 20 MHz-sonden har en relativt høj frekvens, har sonden en høj opløsning, men indtrængningsafstanden er kort. Observationsområdet er inden for 1 cm fra radius omkring sonden.
Ved normalt, ventileret og luftfyldt lungeparenkym vil alle ultralydsbølger blive reflekteret, og miniproben producerer et snestormslignende “white-out” ultralydsbillede (figur 1a), selv når læsionen er tæt på spidsen af sonden, men adskilt af et lille mellemliggende luftlag. Hvis læsionen kan nås endobronkialt, og spidsen kan placeres i eller ved siden af læsionen, vil billedet ændre sig (figur 1b).
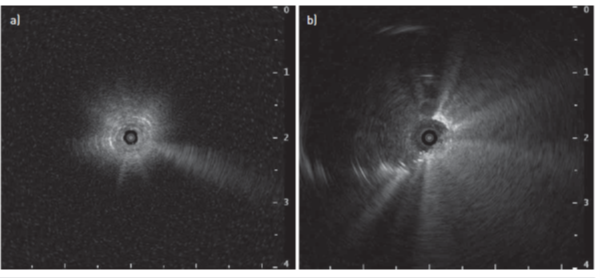
Figur 1
Solide tumorer kan normalt tydeligt skelnes mod det normale lungevæv ved en lys kant. Det sono-morfologiske billede af en tumor fremstår gråt og for det meste homogent (figur 2a), selvom nekrotiske områder og kar kan ses som omskrevne sorte områder. Ydermere bør eksistensen af en kontinuerlig hyperekkoisk margin og fravær af et lineært-diskret luftbronkogram give anledning til at mistænke malignitet. I modsætning hertil har ultralydsbilleder af inflammatorisk væv eller atelektase et heterogent udseende, forårsaget af de forskellige strukturer i lungen. Små bronkier, der indeholder fanget luft, er synlige som skarpe, hvide ekko-pletter. De væskefyldte områder ser mørke ud, og kanterne er lidt slørede (figur 2b).
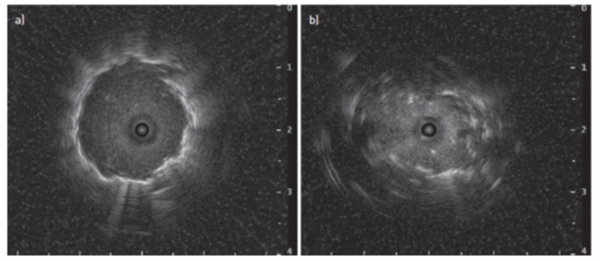
Figur 2
Hos patienter med lepidic adenocarcinom kan ultralydsbilledet imidlertid have et udseende svarende til inflammatorisk væv, og det er ofte vanskeligt at skelne mellem det klassiske benigne og ondartede udseende.
Selvom brugen af radiale miniprober i den perifere lunge teknisk er ligetil, kan det ofte være svært at fortolke resultaterne. Væske fremstilles sort ultrasonografisk, men Doppler-funktionen er ikke tilgængelig i den radiale ultralydsprobe til at skelne mellem nekrotiske områder og kar. Her kan der i stedet forsøges kortlægning af strukturens forløb eller lede efter arteriel vaskulær pulsation. Indespærret luft fører til skarpe, hvide pletter med et “komethale ”-tegn bagved, som ikke må forveksles med forkalkninger. Enhver kraftig refleksion vil skabe gentagne ekkoer, der kan genkendes på deres ensartede intervalafstand.
Miniproben er en fleksibel probe, som kan føres ind i de relevante subsegmentale bronkier, hvor der er mistanke om, at læsionen er lokaliseret. Dette kan være svært, når sonden skal bøjes; derudover skal overdreven friktion undgås for at beskytte transduceren og den forbindende drivledning mod beskadigelse. En vandfyldt ballon over transduceren er normalt ikke nødvendig i den perifere lunge. Læsionen er nået, når ultralydsbilledet viser en solid rund eller oval læsion (figur 2a). Desværre kan biopsierne ikke tages under visuel kontrol i realtid. Miniproben skal fjernes, før der indføres et biopsiværktøj i arbejdskanalen. Vanskeligheden ved derefter at skulle navigere tilbage til læsionen kan reduceres ved at bruge en sheath og / eller lade sig vejlede af et fluoroskop.
Når læsionen er lokaliseret ved hjælp af radial EBUS, er transbronkial biopsitagning med en tang den mest almindelige prøvetagningsteknik. Det diagnostiske udbytte afhænger af størrelsen og synligheden af læsionen ved ultralydsbilledet. Mindre noduli er sværere at nå, men udbyttet vil være højere, hvis en bronchus fører direkte til læsionen, og sonden kan placeres i læsionen. Der kan dog anvendes alternative eller yderligere biopsiværktøjer. Yderligere brug af nål (TBNA) eller et tyndt aspirationskateter kan øge det diagnostiske udbytte. Dette gælder især, hvis miniproben kun kan placeres ved siden af, men ikke direkte inde i knuden. Kryoprober benyttes normalt til at tage endo- eller transbronkiale biopsier til diagnostik af endobronkiale tumorer eller diffus interstitiel lungesygdom, men disse prober er også effektive til at tage prøver af perifere lungeinfiltrater. Fordelen ved kryobiopsier er den større størrelse af prøverne, bedre bevaret histologisk arkitektur med færre knusningsartefakter og mulighed for at opnå væv fra den anden side af bronkialvæggen i den førende bronkus. Ulempen er dog, at bronkoskopet skal fjernes helt med kryoproben og den vedhæftede prøve, hvilket derefter kræver gentagen navigation mod læsionen. De større biopsier indebærer også en større blødningsrisiko end konventionel bioptering med tang.
I øjeblikket er tre forskellige teknikker til sampling fra en given læsion ved radial EBUS tilgængelige:
Den første er at tage biopsier “blindt” fra det samme subsegment efter at have påvist læsionen og fjernet ultralydsproben. Den anden tilgang er at bruge fluoroskopi til at dirigere miniproben til læsionen og til at kontrollere, at biopsiværktøjet er i samme position, som ultralydsproben var på tidspunktet for det ultrasonografiske billede (slagskyggen), før der derefter tages biopsier. Den tredje og mest almindelige teknik involverer fremføring af ultralydsproben inde i en plastik-sheath, der bruges som en forlænget arbejdskanal. Proben indsættes således i et lille kateter, og begge føres sammen gennem bronkoskopets arbejdskanal til den perifere lunge. Miniproben fjernes efter at have nået læsionen, hvorimod sheaten efterlades tæt på eller inden for læsionen. Det er derefter muligt at introducere forskellige biopsiværktøjer gennem sheaten direkte til området af interesse. Denne teknik kan også bruges til at diagnosticere perifere lungelæsioner, der ikke er synlige under fluoroskopi, eller som er < 20 mm.
Radial EBUS er et sikkert og relativt præcist værktøj til undersøgelse af perifere lungelæsioner, hvilket øger sandsynligheden for at opnå en diagnose, og mindsker behovet for kirurgisk biopsi eller transtorakal nålebiopsi.
Kombination af radial EBUS med andre navigationsteknikker (f.eks. ENB) kan yderligere forbedre den diagnostiske nøjagtighed for perifere pulmonale læsioner. Den diagnostiske sensitivitet ved sampling med radial EBUS varierer fra 58-88 %. Den store variation i de rapporterede data skyldes studiernes heterogene designs med store metodologiske forskelle, fx om radial EBUS er blevet kombineret med andre navigeringsmodaliteter (fx CT, ENB, fluoroskopi) samt heterogenitet svarende til de perifere læsioners karakteristika (størrelse, morfologi og lokalisation).
Elektromagnetisk navigationsbronkoskopi (ENB):
ENB repræsenterer en anden tilgang til diagnosticering af perifere pulmonale infiltrater. ENB tillader billedbaseret styring af bronkoskopet til en mållæsion i den perifere lunge, svarende til de teknikker, der er beskrevet tidligere, men med yderligere realtidsbekræftelse af navigationskateterets position i kroppen ved hjælp af et elektromagnetisk felt.
Det elektromagnetiske navigationssystem inkorporerer flere teknologiske delkomponenter til dels at danne en præprocedural computermodel med et virtuelt bronkietræ ud fra den foreliggende CT-skanning, hvor ruten til infiltratet kan planlægges (virtuel bronkoskopi) via et softwareprogram, og dels under proceduren en GPS-lignende elektromagnetisk navigation (EMN) med lokalisering og vejledning i realtid og et kateter, hvorigennem instrumenter kan indføres.
Det mest almindeligt anvendte og undersøgte ENB-system er SuperDimension (Medtronic, Minneapolis, USA).

SuperDimension har 4 grundlæggende komponenter:
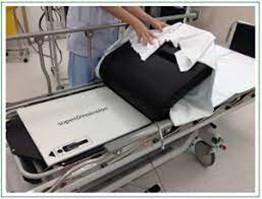
1) En elektromagnetisk plade (47 x 56 cm og 1 cm tyk), der udsender lave elektromagnetiske bølger, og som placeres under den kranielle ende af sengelejet under madrassen for at skabe et elektromagnetisk felt omkring patientens thorax.
2) En lokaliserbar guide (LG), der har en sensorprobe. Kateteret kan fås i forskellige vinkler til at dirigere proben. Sensorproben er seponerbar, og er monteret på spidsen af LG. Sensorproben er systemets kardinalfunktion. Når det først er placeret i det elektromagnetiske navigationsfelt, bliver dets position i x-, y- og z-akser samt i bevægelse (rotation, fremad og bagud) fanget af EMN-systemet og vist på skærmen i realtid. Disse billeder er overlejret på tidligere erhvervede CT-billeder.

3) Et fleksibelt kateter, der fungerer som en forlænget arbejdskanal (EWC) er 107 cm langt med en ydre diameter på 2,68 mm og en indvendig diameter på 2,08 mm. Katetrene fås i forskellige vinkler (fx 45°, 90°, 180°, så de kan navigere i vanskelige luftveje afhængigt af mållæsionen og den planlagte vej. LG placeres i kateteret, og når målet er fundet med navigationssystemet, placeres EWC på denne placering og genererer adgang til de bronkoskopiske biopsiværktøjer. Når spidsen af bronkoskopet er kilet ind i den segmentelle bronchus af interesse, fremføres LG sammen med EWC under vejledning fra navigationssystemet. Når det ønskede mål er nået, trækkes LG tilbage og efterlader EWC på plads. Endobronkialt tilbehør (nål, børste, tang) indsættes derefter gennem EWC for at bioptere målet (= læsionen).
4) Planlægningscomputeren og dens hardware. Softwaren konverterer den digitale billeddannelse og kommunikation i medicinstandarder (DICOM) fra en CT-scanning til multiplanar billeder med 3-dimensionel (3D) rekonstruktion og virtuel bronkoskopi af luftvejene. Disse rekonstruerede billeder er overlejret af den grafiske information, der repræsenterer positionen af sensorsonden samt forudidentificerede anatomiske vartegn og placeringen af mållæsionen.
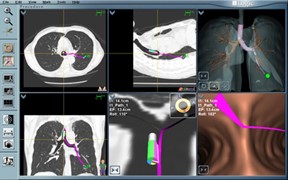
Planlægningssoftwareprogrammet giver billeder af thorax på koronal, sagittal og aksial måde samt et virtuelt bronkoskopisk billede og en 3-dimensionel repræsentation af patientens trakeobronkiale træ og pleura. Disse billeder bruges til at planlægge alle aspekter af proceduren. Hovedcomputersoftwaren og monitoren giver bronkoskopøren mulighed for at se de rekonstruerede billeder af patientens anatomi sammen med overlejret grafisk information, der viser positionen af LG’en samt positionen af mållæsionen.
Det virtuelle 3D-bronkiale træ, der er muliggjort med teknologien, strækker sig dybt ind i lungeparenkymet og muliggør adskillige automatiserede funktioner såsom automatisk registrering, automatiseret ruteplanlægning og luftvejssynkronisering. Yderligere tilbyder de tilpassede højopløsningsvisninger, flere navigationsperspektiver for at forbedre detektion og diagnose.
Proceduren har fire adskilte faser:
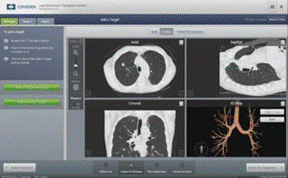
- Planlægning: En CT-scanning af thorax downloades i ENB-softwaren, og den multiplanære digitale information tillader opbygning af aksiale, koronale og sagittale visninger og virtuelle billeder af bronkialtræet. Programmet stiller visse krav til CT-skanningen. Således skal der være en snittykkelse på 1-2 mm med mindst 25% overlap mellem de enkelte snit. Endvidere må scanningsmatrixen ikke overstige 512 x 512. Bronkoskopøren bruger herefter denne information til at etablere vejen til mållæsionen.
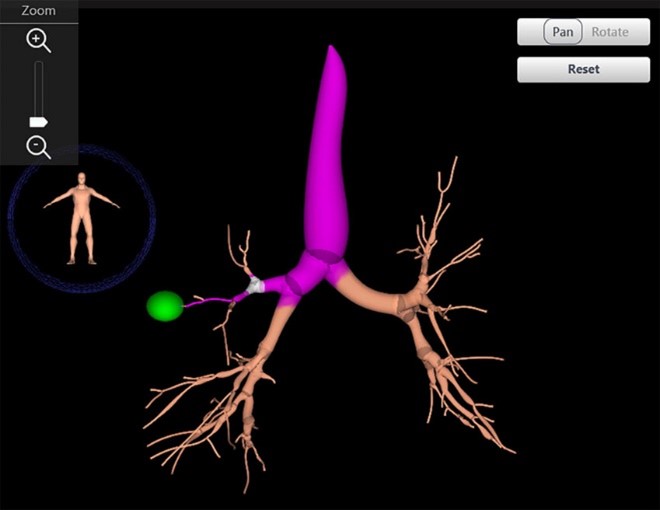
2) Registrering eller endobronkial kortlægning: Når patienten ligger på undersøgelseslejet, placeres 3 sensorer på forsøgspersonens thorax til kompensation for respirationsbevægelser og eventuel bevægelse på lejet. Derefter indføres bronkoskopet i luftvejene med LG indsat gennem arbejdskanalen. Sensoren (eller LG) laver hundredvis af positionsregistreringspunkter, som overlejres og matches til den virtuelle 3D-bronkoskopi.
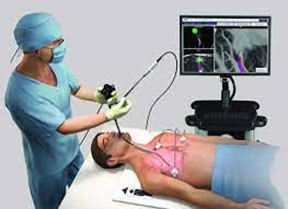
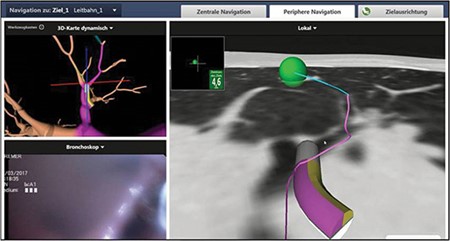
3) Navigation: Når registreringen er gennemført, føres bronkoskopet med sensoren ud i den distale ende i luftvejene på vej mod lungelæsionen. LG og EWC styres af EMN-monitoren, som viser grafisk information, der repræsenterer sensorproben, anatomiske pejlemærker og placeringen af mållæsionen. Målet er at være så tæt som muligt, men opretholde en direkte linje fra enden af LG til mållæsionen i det korrekte plan.
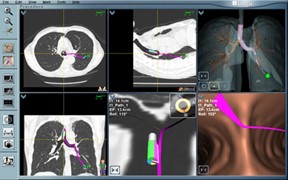
4) Biopsi: Placeringen af mållæsionen kan bekræftes ved fluoroskopi eller / og radial EBUS (miniprobe). EWC er fastgjort til arbejdskanalporten. LG fjernes derefter fra EWC. Bronkoskopiværktøjerne (tang, børste, nål) kan indsættes for at tage prøver.
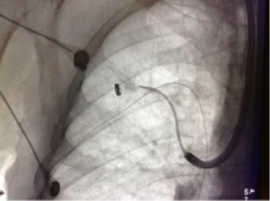
ENB er en gennemprøvet modalitet, hvor der efterhånden er opnået stor klinisk erfaring i brugen heraf, og der foreligger adskillige studier vedr. diagnostisk sensitivitet og patientsikkerhed.
Selvom der mangler store randomiserede studier, har de publicerede data vist en diagnostisk sensitivitet på 44-75 % (gennemsnitligt 65 %). Den store variation skyldes studiernes heterogene metodologi inklusiv studiedesign, små ”sample size”, og forskelle i tilgangen til de perifere læsioners karakteristika (størrelse, morfologi og lokalisation). Et randomiseret studie (Eberhardt et al.) har vist en superior diagnostisk sensitivitet ved kombination af ENB med radial EBUS (88 %) fremfor ENB alene (59 %) eller radial EBUS alene (69 %). Et nyligt systematisk review har dog belyst at der kun er sparsomme data på område, hvorfor der er behov for, at data fra Eberhardt studiet underbygges af yderligere forskning på området.
Andre ENB-systemer:
En anden version af ENB er Veran Spin-navigeret bronkoskopisystem, som bruger procedurer i realtid til at tage højde for respiratorisk gating, der forsøger at overvinde problemerne med respirationsbevægelser, mens der tages biopsier.

Systemet har de samme grundlæggende ENB-elementer. Brug af vPAD (klistermærker med elektromagnetiske sensorer) på patientens bryst før planlægnings-CT eliminerer imidlertid behovet for registreringstrinnet, hjælper med at vejlede navigationen og sporer patientens vejrtrækning. Planlægnings-CT‘en udføres i både inspiratoriske og eksspiratoriske faser for at forbedre nøjagtigheden af navigationen. De forskellige kateterdesigns har også betydelige fordele ved, at i modsætning til SuperDimension-systemet forbliver navigation aktiveret under biopsiproceduren. Desuden er det muligt at udføre en navigationsguided transtorakal nåleaspirationsbiopsi (TTNAB) efter ikke-diagnostisk navigationsbronkoskopi under samme seance.
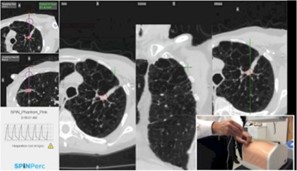
Kontraindikationer til ENB:
De generelle kontraindikationer for at udføre ENB er de samme som for konventionel bronkoskopi (fx koagulationsforstyrrelser, ustabil hæmodynamik mm.).
En unik relativ kontraindikation til ENB er, hvis patienten er udstyret med kardial pacemaker / ICD-enhed. Årsagen er genereringen af det elektromagnetiske felt under proceduren, hvilket potentielt kan kompromittere funktionen af de elektriske enheder. Et nyligt publiceret studie med inklusion af 24 patienter, som var udstyret med pacemaker / ICD-enhed, og som gennemgik en ENB-procedure, har dog vist, at ingen af patienterne oplevede arrytmi eller forstyrrelse af deres elektriske enhed, og at proceduren blev afviklet uden komplikationer hos alle patienterne. Der er behov for yderligere data til at bekræfte dette, hvorfor der for nuværende fortsat er anbefaling om enten at konsultere det kardiologisk speciale mhp. at ændre indstillingerne for en given elektrisk enhed forud for en ENB-procedure eller vælge en anden udredningsmodalitet for disse patienter.
4. UDVÆLGELSE AF MODALITET
Når beslutningen om invasive udredning af en perifer lungelæsion er truffet, skal der vælges en modalitet til lokalisering og bioptering af denne. Der er ikke en bred konsensus blandt hverken klinikere eller guidelines omkring hvilken modalitet, som vælges hvornår. Meget vil afhænge af individuelle præferencer, men faktorer, som ofte vil indgå i overvejelserne, er størrelse af læsionen, lokalisation, patientprofil herunder tilstedeværelse af emfysem samt lokale organisatoriske forhold såsom adgang til udstyr og faglig ekspertise. Valget står ofte mellem transtorakal biopsitagning (TTNB) eller endoskopisk udredning med enten konventionel bronkoskopi eller med tillæg af en eller flere endoskopiske modaliteter.
Der foreligger ikke randomiserede studier på sammenligning af endoskopiske modaliteter med TTNB, men ud fra foreliggende rapporterede data er den diagnostiske sensitivitet for endoskopisk diagnostik lavere end for TTNB (60-70 % versus op til > 88 %). Risikoen for komplikationer ved TTNB er til gengæld også meget højere end for endoskopisk diagnostik, hvor risikoen for pneumothorax er rapporteret fra 20-40 % mod under 4 % for endoskopi.
Selvom der ikke er en enkel optimal modalitet, som tager højde for alt, er mange eksperter er enige i følgende strategier:
- UL / CT-vejledt TTNB kan foretrækkes ved perifere noduli som er lokaliseret tæt ved thoraxvæggen eller ved dybereliggende læsioner, såfremt en fissur ikke skal penetreres i forbindelse med biopsitagning og der ikke er betydende emfysem i området (hvilket markant øger risikoen for pneumothorax). Denne præference beror på, at TTNB generelt har en højere rapporteret diagnostisk sensitivitet end endoskopisk diagnostik, specielt for små perifere noduli.
- De endoskopiske modaliteter herunder et eller flere i kombination er hensigtsmæssige alternativer grundet lav risiko for komplikationer og bør under alle omstændigheder overvejes som førstevalg hos patienter med mere centrale læsioner (central 2/3 af lungen), høj risiko for pneumothorax eller blødning herunder hos skrøbelige patienter hvor en eventuel udvikling af en eller flere komplikationer ved TTNB kan være livstruende. En skrøbelig patient kan defineres ved fx mange komorbiditeter evt. i kombination med høj alder, respirationsinsufficiens med lave lungefysiologiske værdier eller dårlig performance status. Ofte vil det være en kombination af flere af de angivet faktorer.
- Kirurgisk biopsi ved VATS teknik bør reserveres til de patienter, hvor initial udredning med enten TTNB og / eller endoskopisk diagnostik ikke har kunnet etablere en sikker diagnostisk afklaring, og hvor der fortsat er høj risiko for malignitet. Kirurgisk udredning i generel anæstesi forudsætter dog også, at patienten er i stand til at gennemgå denne – de samme overvejelser som tidligere anført.
REFERENCER
- Gould MK, Tang T, Liu IL, et al. Recent Trends in the Identification of Incidental Pulmonary Nodules. Am J Respir Crit Care Med 2015; 192:1208.
- Nationwide Evaluation of X-Ray Trends (NEXT): Computed Tomography 2005-2006 Preliminary Summary. Conference of Radiation Control Program Directors, Inc. July 2012
- Wang Memoli JS, Nietert PJ, Silvestri GA. Meta-analysis of guided bronchoscopy for the evaluation of the pulmonary nodule. Chest 2012; 142:385.
- National Lung Screening Trial Research Team, Aberle DR, Adams AM, et al. Reduced lung-cancer mortality with low-dose computed tomographic screening. N Engl J Med 2011; 365:395.
- Marino KA, Sullivan JL, Weksler B. Electromagnetic Navigation Bronchoscopy for Identifying Lung Nodules for Thoracoscopic Resection. Ann Thorac Surg 2016; 102:454.
- Khan AY, Berkowitz D, Krimsky WS, et al. Safety of pacemakers and defibrillators in electromagnetic navigation bronchoscopy. Chest 2013; 143:75.
- Asano F, Eberhardt R, Herth FJ. Virtual bronchoscopic navigation for peripheral pulmonary lesions. Respiration 2014; 88:430.
- Ishida T, Asano F, Yamazaki K, et al. Virtual bronchoscopic navigation combined with endobronchial ultrasound to diagnose small peripheral pulmonary lesions: a randomised trial. Thorax 2011; 66:1072.
- Asano F, Shinagawa N, Ishida T, et al. Virtual bronchoscopic navigation combined with ultrathin bronchoscopy. A randomized clinical trial. Am J Respir Crit Care Med 2013; 188:327.
- Mahajan AK, Patel S, Hogarth DK, Wightman R. Electromagnetic navigational bronchoscopy: an effective and safe approach to diagnose peripheral lung lesions unreachable by conventional bronchoscopy in high-risk patients. J Bronchology Interv Pulmonol 2011; 18:133.
- Gould MK, Donington J, Lynch WR, et al. Evaluation of individuals with pulmonary nodules: when is it lung cancer? Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2013; 143:e93S.
- Rivera MP, Mehta AC, Wahidi MM. Establishing the diagnosis of lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2013; 143:e142S.
- Eberhardt R, Anantham D, Ernst A, et al. Multimodality bronchoscopic diagnosis of peripheral lung lesions: a randomized controlled trial. Am J Respir Crit Care Med 2007; 176:36.
- Gex G, Pralong JA, Combescure C, et al. Diagnostic yield and safety of electromagnetic navigation bronchoscopy for lung nodules: a systematic review and meta-analysis. Respiration 2014; 87:165.
- Gildea TR, Mazzone PJ, Karnak D, et al. Electromagnetic navigation diagnostic bronchoscopy: a prospective study. Am J Respir Crit Care Med 2006; 174:982.
- Makris D, Gourgoulianis KI. Electromagnetic navigation diagnostic bronchoscopy and transbronchial biopsy. Chest 2008; 133:829.
- Seijo LM, de Torres JP, Lozano MD, et al. Diagnostic yield of electromagnetic navigation bronchoscopy is highly dependent on the presence of a Bronchus sign on CT imaging: results from a prospective study. Chest 2010; 138:1316.
- Eberhardt R, Morgan RK, Ernst A, et al. Comparison of suction catheter versus forceps biopsy for sampling of solitary pulmonary nodules guided by electromagnetic navigational bronchoscopy. Respiration 2010; 79:54.
- Folch EE, Pritchett MA, Nead MA, et al. Electromagnetic Navigation Bronchoscopy for Peripheral Pulmonary Lesions: One-Year Results of the Prospective, Multicenter NAVIGATE Study. J Thorac Oncol 2019; 14:445.
- Yarmus LB, Arias S, Feller-Kopman D, et al. Electromagnetic navigation transthoracic needle aspiration for the diagnosis of pulmonary nodules: a safety and feasibility pilot study. J Thorac Dis 2016; 8:186.
- Mallow C, Lee H, Oberg C, et al. Safety and diagnostic performance of pulmonologists performing electromagnetic guided percutaneous lung biopsy (SPiNperc). Respirology 2019; 24:453.
- Yarmus L, Akulian J, Wahidi M, et al. A Prospective Randomized Comparative Study of Three Guided Bronchoscopic Approaches for Investigating Pulmonary Nodules: The PRECISION-1 Study. Chest 2020; 157:694.
- Sainz Zuñiga PV, Vakil E, Molina S, et al. Sensitivity of Radial Endobronchial Ultrasound-Guided Bronchoscopy for Lung Cancer in Patients With Peripheral Pulmonary Lesions: An Updated Meta-analysis. Chest 2020; 157:994.
- Chen A, Chenna P, Loiselle A, et al. Radial probe endobronchial ultrasound for peripheral pulmonary lesions. A 5-year institutional experience. Ann Am Thorac Soc 2014; 11:578.
- Steinfort DP, Khor YH, Manser RL, Irving LB. Radial probe endobronchial ultrasound for the diagnosis of peripheral lung cancer: systematic review and meta-analysis. Eur Respir J 2011; 37:902.
- Chen AC, Loiselle A, Zhou L, et al. Localization of Peripheral Pulmonary Lesions Using a Method of Computed Tomography-Anatomic Correlation and Radial Probe Endobronchial Ultrasound Confirmation. Ann Am Thorac Soc 2016; 13:1586.
- Mondoni M, Sotgiu G, Bonifazi M, et al. Transbronchial needle aspiration in peripheral pulmonary lesions: a systematic review and meta-analysis. Eur Respir J 2016; 48:196.
- Shinagawa N, Yamazaki K, Onodera Y, et al. CT-guided transbronchial biopsy using an ultrathin bronchoscope with virtual bronchoscopic navigation. Chest 2004; 125:1138.
- Hautmann H, Henke MO, Bitterling H. High diagnostic yield from transbronchial biopsy of solitary pulmonary nodules using low-dose CT-guidance. Respirology 2010; 15:677.
- Ost D, Shah R, Anasco E, et al. A randomized trial of CT fluoroscopic-guided bronchoscopy vs conventional bronchoscopy in patients with suspected lung cancer. Chest 2008; 134:507.
- Oki M, Saka H, Ando M, et al. Ultrathin Bronchoscopy with Multimodal Devices for Peripheral Pulmonary Lesions. A Randomized Trial. Am J Respir Crit Care Med 2015; 192:468.
- Oki M, Saka H, Asano F, et al. Use of an Ultrathin vs Thin Bronchoscope for Peripheral Pulmonary Lesions: A Randomized Trial. Chest 2019; 156:954.
- Hayama M, Izumo T, Matsumoto Y, et al. Complications with Endobronchial Ultrasound with a Guide Sheath for the Diagnosis of Peripheral Pulmonary Lesions. Respiration 2015; 90:129.
- Khandhar SJ, Bowling MR, Flandes J, et al. Electromagnetic navigation bronchoscopy to access lung lesions in 1,000 subjects: first results of the prospective, multicenter NAVIGATE study. BMC Pulm Med 2017; 17:59.
- Cicenia J, Bhadra K, Sethi S, et al. Augmented Fluoroscopy, a new and novel navigation platform for peripheral bronchoscopy.
- Andersen FD, Degn KB, Riis Rasmussen T. Electromagnetic navigation bronchoscopy for lung nodule evaluation. Patient selection, diagnostic variables and safety. Clin Respir J. 2020 Jun;14(6):557-563. Doi: 10.1111/crj.13168. Epub 2020 Feb 24. PMID: 32052591.
- Juul AD, Falster C, Rasmussen TR, Hilberg O, Jacobsen N, Arshad A, Laursen CB. Does the Addition of Radial Endobronchial Ultrasound Improve the Diagnostic Yield of Electromagnetic Navigation Bronchoscopy? A Systematic Review. Respiration. 2022 Jun 7:1-9. doi: 10.1159/000524671. Epub ahead of print. PMID: 35671710.
- Tanaka M, Matsumoto Y, Imabayashi T, Kawahara T, Tsuchida T. Diagnostic value of a new cryoprobe for peripheral pulmonary lesions: a prospective study. BMC Pulm Med. 2022 Jun 10;22(1):226. doi: 10.1186/s12890-022-02003-0. PMID: 35689261; PMCID: PMC9188163.