Denne instruks er målrettet læger, som har deltaget i et uddannelsesprogram i fokuseret lungeultralyd samt til læger, der er interesseret i hvad fokuseret lungeultralyd kan. DLS og ultralydsudvalget anbefaler at man tilmelder sig et kursus jf. pkt 2.1 før man går i gang med at skanne.
I denne instruks vil man kunne læse om:
- Udførelse samt protokol
- Indstillinger
- Den normale fokuserede lungeultralyd
- Samt patologiske fokuserede lungeultralyd inkl. Diagnosticering af:
- Interstitielt syndrom (lungeødem)
- Pneumothorax
- Pleuraeffusion
- Vurdering af patologi i lungeparenkymet
- Beskrivelse af scanningen
- Uddannelse og certificering.
1.1. BAGGRUND OG DEFINITION
Brugen og populariteten af fokuseret lungeultralydsskanning (FLUS) er steget markant inden for de seneste år. Primært grundet evnen som supplerende diagnostisk værktøj til både udredning og monitorering af patienter med dyspnø og andre respiratoriske
symptomer. FLUS har vist sig at være konventionelt røntgen af thorax diagnostisk
overlegent i en lang række akutmedicinske tilstande, herunder lungeødem og pneumothorax [1-4]. Derudover er FLUS en bekvem, hurtig og strålefri undersøgelse, som kan foretages på stuen og uden at flytte patienten (bed-side).
Som anført nedenfor, anvendes der en fokuseret tilgang til vurdering af FLUS-fundene med besvarelse af dikotome spørgsmål (ja/nej), f.eks. ”Er der tegn til pneumothorax?”.
Dette er i modsætning til den regelrette diagnostiske lungeultralydsskanning (LUS), hvor undersøgeren foretager en komplet undersøgelse med henblik på at identificere al synlig patologi. Ved en diagnostisk lungeultralydsundersøgelse foretages både en morfologisk og kvantitativ vurdering af eventuel patologi ligesom der kan suppleres med brug af avancerede modaliteter, som kontrastforstærket lungeultralyd. Den diagnostiske undersøgelse kan udover skanning af thorax med henblik på vurdering af lungerne, også inkludere vurdering af mediastinum, pleura, diafragma, og hals.
Den fulde diagnostiske LUS er mere tidskrævende og kræver større erfaring og kompetencer før selvstændige skanninger kan foretages. Med hensyn til diagnostisk LUS anbefales i stedet litteratur fra European Respiratory Society (ERS) [5]. Denne retningslinje omhandler kun brugen af FLUS.
1.2. INDIKATION
FLUS anvendes som supplement til anamnese, objektiv undersøgelse og øvrige parakliniske undersøgelser i den diagnostiske vurdering eller monitorering af patienter med akut eller subakut opståede respiratoriske symptomer som ved f.eks.:
- Dyspnø
- Objektive tegn på respirationsinsufficiens
- Brystsmerter
- Klinisk mistanke om pneumoni
- Klinisk mistanke på pleural affektion
1.3. SKANNINGSPROCEDURE
1.3.1. Klargøring af apparatur
Efter opstart af skanner oprettes patientundersøgelse med indtastning af patient ID.
1.3.2. Transducervalg
Transducervalget er afhængigt af kliniske problemstilling (inkl. patient-mobilitet), tilgængeligt UL-apparatur, og om FLUS er en del af flere ultralydsundersøgelser. I så fald er en all-around transducer til flere undersøgelser er at foretrække.
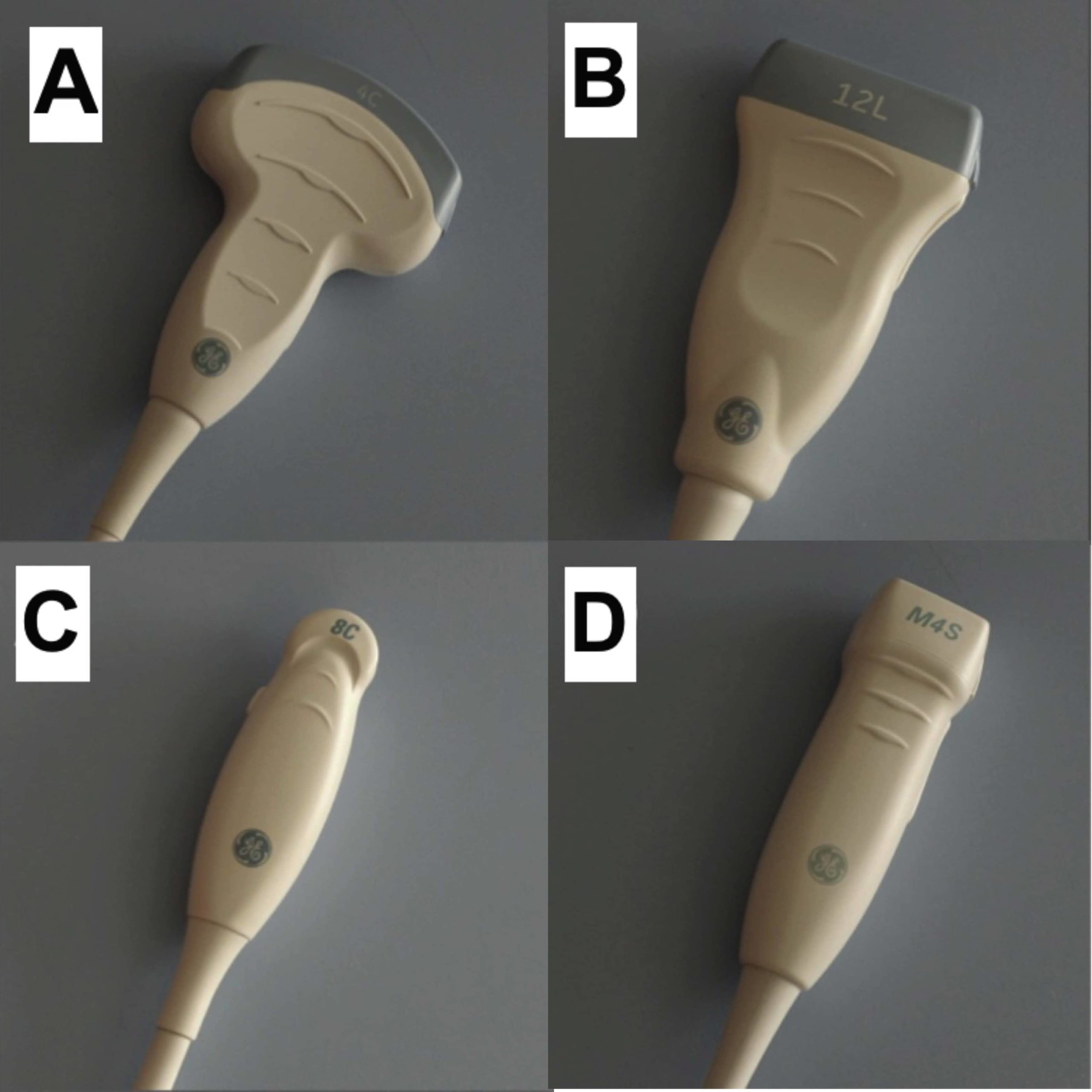
Figur 1. A: Konveks (abdominal) transducer. B: Lineær trans-ducer. C: Mikrokonveks transducer. D: Sektor (kardiel) transducer.
Den konvekse abdominale transducer anbefales (A) som førstevalg. Transduceren er lavfrekvent og giver et acceptabelt billede af både superficielle og profunde strukturer. En højfrekvent lineær transducer (B) kan anvendes, hvis man med FLUS udelukkende ønsker at foretage vurdering af pleuralinjen mhp. at udelukke pneumothorax.
Den mikrokonvekse transducer (C) kan være et alternativ / supplement ved liggende patienter, da dennes størrelse er nemmere at skanne lungernes posteriore flader med.
En kardiel transducer (D) kan pga. forringet billedkvalitet af superficielle strukturer vanskeliggøre diagnostik af pneumothorax og mindre lungekonsolideringer. Transduceren frarådes derfor som standardvalg, men hvis FLUS er et supplement til en ekkokardiografi, kan den bruges til at vurdere om der er tegn til lungeødem eller pleuraeffusion. Transduceren er god til at fremhæve septae ved komplicerede parapneumoniske effusioner eller empyem.
Efter valg af transducer bestemmes preset, dvs. den standard-softwareindstilling der som udgangspunkt er den optimale ved undersøgelse af en given struktur (f.eks. hjerte, lunge, abdomen). Mange nyere ultralydsapparater har et lunge-preset, men i fravær heraf er abdominal-preset ofte et acceptabelt alternativ.
OBS: Man bør være opmærksom på om funktioner, der fjerner eller minimerer artefakter (f.eks. Harmonics, Cross Beam) er slået til, da visualisering af artefakter indgår som en essentiel del af FLUS.
1.3.3. Patientpositionering
Patientlejring afhænger af den kliniske mistanke, differentialdiagnoser og almentilstand. Da man ved FLUS undersøger for både luft (pneumothorax) og væske (pleuraeffusion), skal patientens positionering altid haves in mente.
Med patienten i siddende stilling er både anteriore, laterale og posteriore flader tilgængelige, og fri væske i thoraxhulen vil således optimalt identificeres i de mest kaudale zoner, hvorimod luft vil identificeres i de mest kranielle zoner. Det er dog oftest teknisk vanskeligt at skanne de mest kranielle dele af pleurahulen grundet anatomiske strukturer (klavikler, proximale costae m.m). Det er derfor nemmest at skanne efter pneumothorax på de anteriore flader med patienten liggende fladt (zonerne 1-2R/L).
Hos patienter uden mulighed for mobilisering til siddende stilling, skannes primært de anteriore og laterale zoner. Ofte vil man dog kunne få transduceren trykket ned i madrassen og ind under patienten, så de posteriore flader helt eller delvist kan visualiseres. Alternativt skannes nederst i zone 3 (se punkt 1.4), og dybden øges (se punkt 1.3.4) mhp. at identificere det såkaldte ”spine sign”. Spine sign henfører til, at columna kun kan identificeres over diafragma, hvis væske eller konsolideret væv (B i figuren nedenfor) fungerer som akustisk vindue, hvorved columna visualiseres profund for væsken/konsolideringen. Under normale omstændigheder kan columna ikke visualiseres gennem det luftfyldte lungeparenkym (A).

Oftest er det nemmest at få det korrekte billede til at identificere spine-sign på patientens højre side grundet leverens størrelse og placering. I venstre side, hvor det akustiske vindue skal gå igennem milten, skal transduceren oftest flyttes mere posteriort (ned mod madrassen når patienten ligger ned), men billedet bliver ofte forstyrret af hjertet, mavesæk og venstre colon fleksur (evt. inkl. luft, der giver luftartefakter).
1.3.4. Transducer-orientering
Transduceren placeres mellem to costae i kraniokaudal retning med orienteringsmarkøren kranielt. Såfremt der skannes i andre planer, skal tranduceren være placeret med markøren mod patientens højre side således, at der på ultralydsskærmens venstre side enten ses patientens højre side eller kraniel retning.
1.3.4. Billedoptimering
Der findes mange funktioner og mulige indstillinger på ultralydsapparater alt afhængig af firma, model og udstyrspakke. Nedenfor gennemgås basale indstillinger ved foretagelse af FLUS:
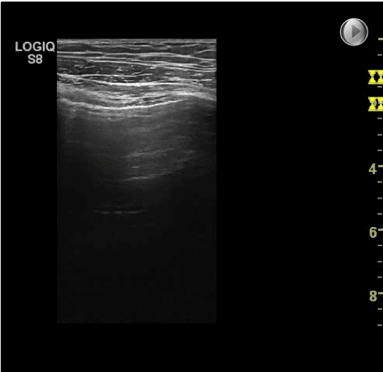
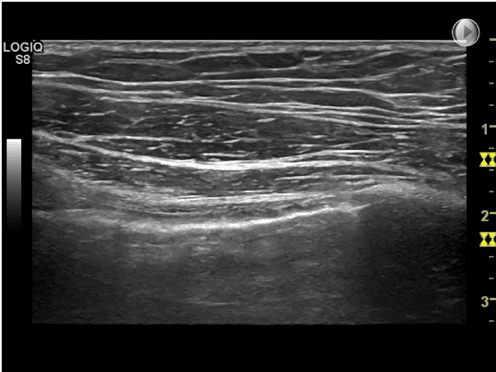
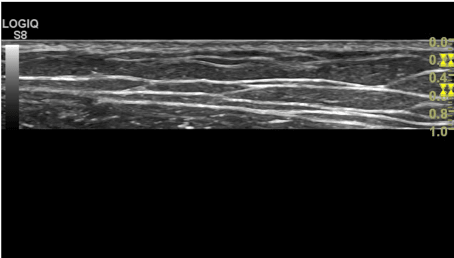
- Dybde: Indstilling af dybde afhænger især af hvilken klinisk mistænkt diagnose, der ønskes undersøgt. Ofte giver en indstilling på 8-10 cm’s dybde et tilstrækkeligt indblik, så både pleuralinie og evt. underliggende artefakter kan visualiseres. På billedet nedenfor ses en FLUS undersøgelse med en lineær transducer og med tre forskellige dybde indstillinger.
Henholdsvis 1 cm, 4 cm og 9 cm (markering af dybden ses med gult i højre side af ultralydsbillederne.
Gain: Med denne funktion justeres ultralydssignalet: forstærkes (billedet bliver lysere) eller mindskes (billedet bliver mørkere). Med for meget gain (for lyst billede) kan det være svært at vurdere pleuralinie, lung sliding og artefakter. Omvendt kan for lidt gain (for mørkt billede) gøre at f.eks. pleuravæske eller konsolidering overses. På billedet nedenfor ses to forskellige gain indstillinger. Der findes ikke en specifik gain-indstilling, som er korrekt til FLUS, det afhænger af apparat, patienten, hvor meget lys og genskind der er i rummet.
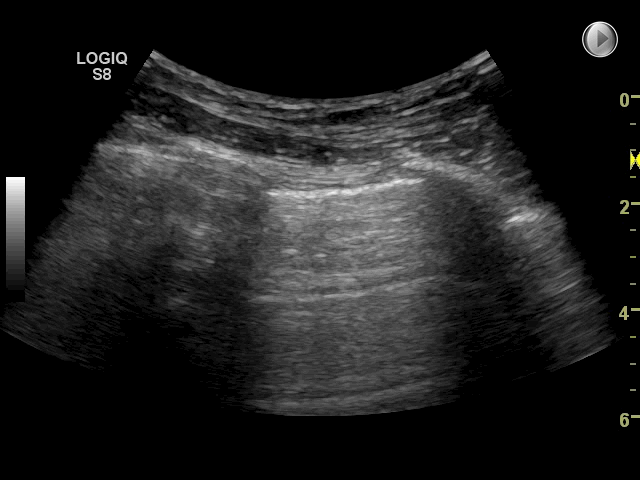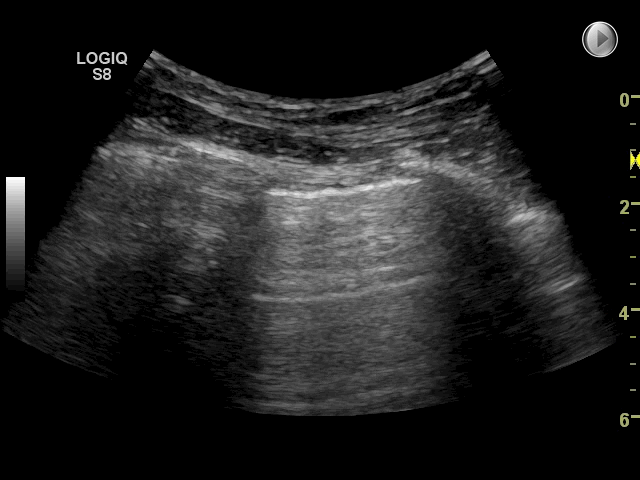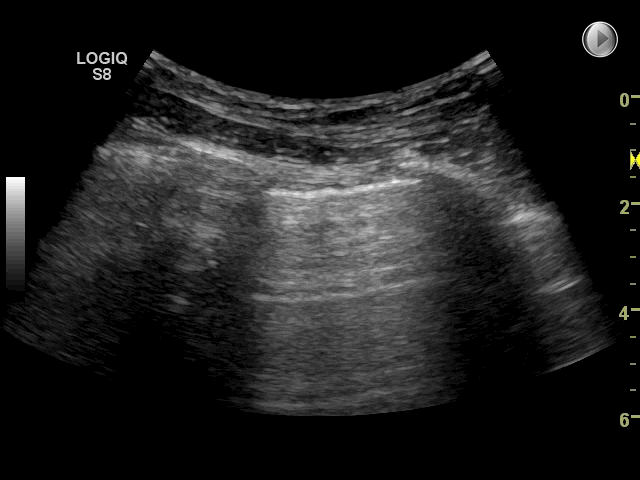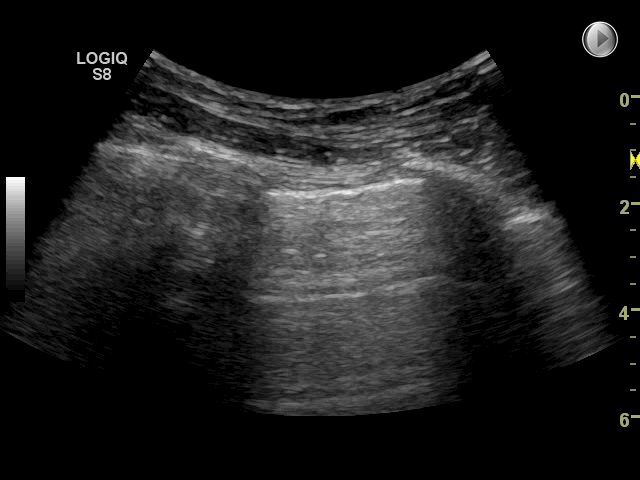
Fokus: Fokuspunktet er den dybde, hvor transduceren forsøger at optimere billedeopløsningen mest muligt. Ved FLUS er det mest optimale at justere placeringen af fokus til dybden omkring pleuralinien eller lige under strukturen der ønskes skannes. Som udgangspunkt anvendes kun ét fokuspunkt. Dog har nogle nyere apparater autofokus, således at dette ikke skal indstilles

1.4. PROTOKOL
Der foreligger mange studier med forskellige skanningsprotokoller til undersøgelse af den respiratorisk påvirkede patient. Nogle studier koncentrerer sig kun om skanning af lungerne, mens andre inkluderer fx. dybe vener og hjerte [6-8]. Lungeultralydsskanning kan ligeledes indgå som en del af helkropsskanninger hos traume patienten som f.eks. ved extended Focused Assessment with Sonography for Trauma (eFAST) [9]
Den mest anvendte protokol har 14 skanningszoner med 7 zoner på hver hemithorax inddelt i 2 anteriore, 2 laterale og 3 posteriore zoner.
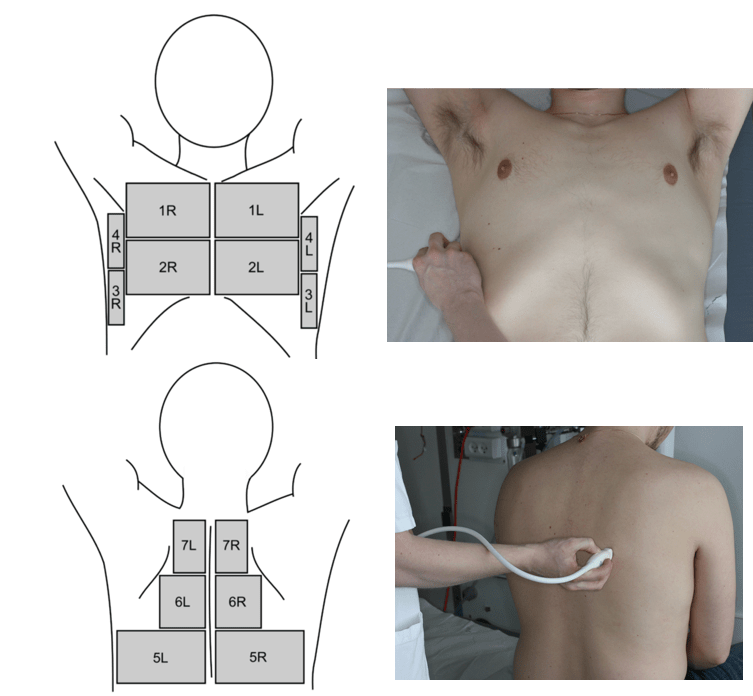
1.4.1. Beskrivelse
For hver skanningszone besvares følgende, dikotome spørgsmål (ja/nej):
- Er der tegn på interstitielt syndrom (signifikant antal B-linie artefakter)?
- Er der tegn på pneumothorax (ophævet lung sliding)?
- Er der tegn på pleuraeffusion?
- Er der anden oplagt lungevævspatologi?
Vurdering af de enkelte, dikotome spørgsmål omtales særskilt nedenfor.
1.5. NORMALE FUND
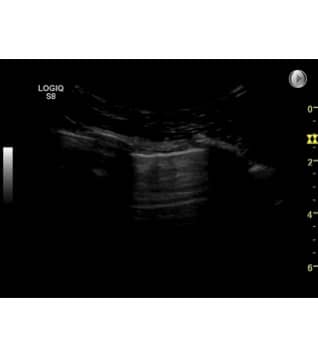
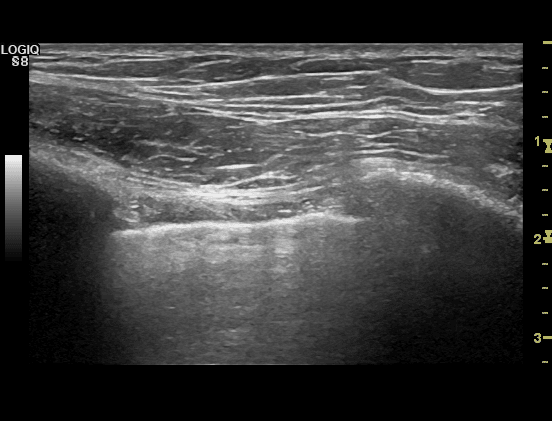
Hos en rask person vil man ved at placere transduceren på tværs af et intercostalrum med orienteringsmarkøren kranielt (jf. punkt 1.4.3) opnå et billede som nedenstående. Mest superficielt ses hud, muskulatur og fascier, mere profund ses overfladen af de to costa som hyperekkoiske horisontale linier med underliggende slagskygge. Lidt mere profund, mellem de to costae (R) ses en horisontal hyperekkoisk linie. Linien repræsenterer pleura viscerale og parietale (P).
Ved en normal ultralydsundersøgelse ses en respirationssynkron horisontal bevægelse af denne linie, hvilket repræsenterer pleura viscerale der under ind- og ekspiration bevæger sig. Denne bevægelse benævnes lung sliding.
Det raske lungeparenkym kan pga. luftindholdet normalt ikke visualiseres med ultralyd. Således er området visualiseret profund for pleuralinien artefaktdannelse og ikke et billede af selve lungeparenkymets anatomi.

1.6. INTERSTITIELT SYNDROM (IS)
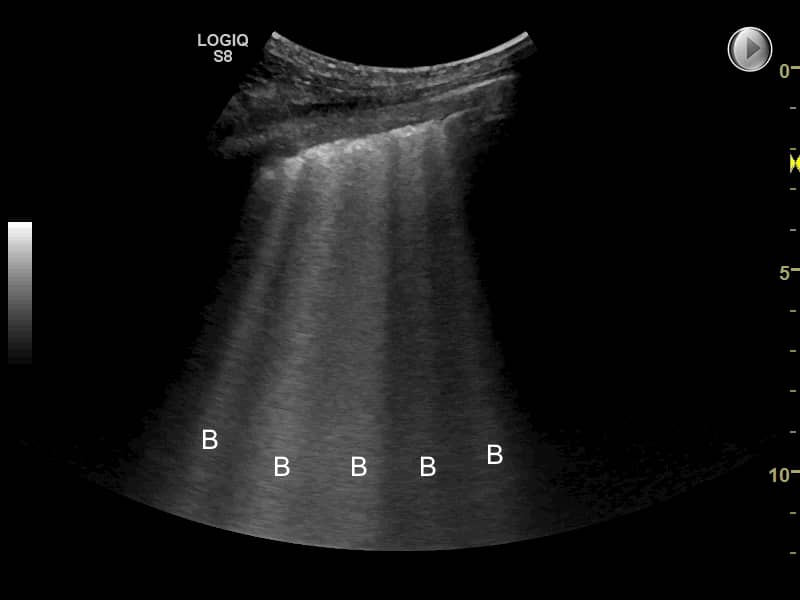
Ved interstitielt syndrom ledes efter tilstedeværelse af reverberations-artefakter (såkaldte B-linier), som er vertikale, hyperekkoiske linier, der udgår fra pleuralinien, bevæger sig respirationssynkront i horisontalplanet og går igennem hele billedet (markeret med B på billede nedenfor). B-linie artefaktet menes at opstå pga. resonansdannelse når ultralydsbølgerne rammer lungevæv med øget densitet.
Forekomsten af enkelte og isolerede B-linier er non-patologisk, og specielt i de laterale, basale zoner kan disse findes hos lungeraske individer. Studier har vist, at op mod 1/3 af lungeraske personer har B-linier i denne zone [8,10]. Tilstedeværelse af B-linier udelukker pneumothorax i det skannede område.
Ved interstitielt syndrom (IS) findes B-linjer diffust og bilateralt. Definitionen er:
- >2 B-linie artefakter pr. intercostalrum i en zone
- Punkt a) tilstede i ≥2 zoner på hver hemithorax
Tilstedeværelse af IS kan ses som indirekte tegn på en diffus tilstand medførende øget densitet af lungevævet i begge lunger. Kardielt betinget lungeødem er en hyppig årsag til IS. Ved FLUS ses typisk B-linier deklivt, og ved udtalt lungeødem ses multiple B-linier i alle zoner. Selve pleuralinien fremtræder oftest intakt og uden fortykkelse. Der ses ofte ledsagende pleuraeffusion og evt. kompressionsatelektase.
I en akut medicinsk setting er FLUS’ øvrige modaliteter (f.eks. rtg. thorax, proBNP) overlegen mht. diagnostisk præcision ved diagnostik af kardielt lungeødem. På baggrund af en høj sensitivitet og negativ prædiktiv værdi kan fravær af IS anvendes til at udelukke lungeødem [11-14]. Såfremt mistanke til kardielt betinget IS anbefales FLUS suppleret med en fokuseret hjerteultralydskanning.
Differentialdiagnoser ved IS: Andre tilstande der medfører diffust øget densitet af lungevævet, f.eks. Acute Respiratory Distress Syndrome (ARDS), non-kardielt lungeødem og interstitiel lungesygdom (ILS) [8]. Ved ILS udløst IS vil man typisk også kunne erkende fortykket og irregulært udseende pleura, evt. med nodulering. Bilateral pneumoni, kan i visse tilfælde også give multiple B-linier bilateralt, men ofte ses ligeledes konsolideret lungevæv basalt evt. med luftbronkogrammer (jf. punkt 1.9.1).
1.7. PNEUMOTHORAX
FLUS-fund kan ved diagnostik af pneumothorax pragmatisk inddeles i tre kategorier: Fund der,
- udelukker pneumothorax
- tyder på pneumothorax
- er diagnostiske for pneumothorax
1.7.1. Fund der udelukker pneumothorax
Som anført kan den normale respirationsafhængige bevægelse af pleurahinderne når patienten trækker vejret/ventileres visualiseres som lung sliding. Tilstedeværelse af lung sliding indikerer følgende i det skannede område:
- Der er ikke luft imellem pleurahinderne
- Lungevolumina ændres
På baggrund af punkt a) kan tilstedeværelse af lung sliding anvendes til at udelukke pneumothorax i det givne område. Lung sliding kan være fraværende eller mindsket grundet apnø, hypoventilation eller f.eks. selektiv intubation af en hovedbronkus. I sidst nævnte tilfælde vil lung sliding ikke være til stede på den non-ventilerede lunge, men derimod kan man oftest se hjertets bevægelse, der synkront med hjertefrekvensen forplanter sig til lungen som små rykvise bevægelser af pleuralinjen. Dette fænomen kaldes lung pulse og udelukker ligeledes pneumothorax [15]. Ligeledes udelukker tilstedeværelse af B-linier pneumothorax
1.7.2. Fund der tyder på pneumothorax
Fravær af lung sliding tyder på pneumothorax, men kan også skyldes anden tilstand som man f.eks. pleurale adhærencer, store bullae, apnø, eller selektiv intubation af hovedbronkus. Manglende lung sliding er derfor ikke et sikkert diagnostik tegn på pneumothorax.
Andre ultralydsfund der kan rejse mistanke om pneumothorax er blandt andet visualisering af subkutant emfysem i thoraxvæggen.
1.7.3. Fund der er diagnostiske for pneumothorax
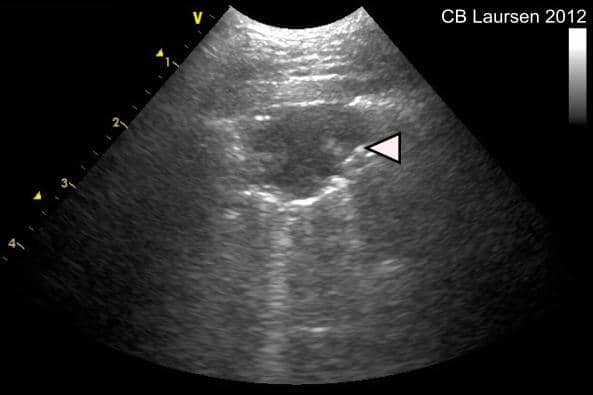
Ved pneumothorax er pleura vicerale ofte stedvis i kontakt med pleura parietale. I disse områder ses fortsat bevaret lung sliding. Ved ventilationen vil områderne med kontakt mellem pleurabladene bevæge sig og medføre lung sliding, mens i områder hvor pleurabladene er adskilt grundet pneumothorax vil lung sliding ikke kunne visualiseres. Med ultralydskanning kan dette præcise sted visualiseres, og overgangen mellem lung sliding og ophørt lung sliding benævnes lung point. Tilstedeværelse af lung point anses som værende diagnostisk for pneumothorax.
Synlig luft i thoraxhulen
Ved samtidig tilstedeværelse af pleuraeffusion vil man dels nogle gange direkte kunne visualisere luftbobler i pleuraeffusionen og der kan ses luftvæskespejl ved overgangen imellem effusion og pneumothorax.

1.8. PLEURAEFFUSION
Pleuraeffusion vil ultrasonografisk oftest ses som et an- eller hypo-ekkoisk område beliggende deklivt mellem de to pleurablade. Effusionen (markeret med PE på billedet nedenfor) vil respektere grænserne til de omkringliggende anatomiske strukturer som f.eks. hjerte, diagfragma (D på billedet) og mediastinum. Billedet viser desuden atelektase (punkt 1.9.4) og lever (Lvr).

Ved ultralydskanning kan man visualisere pleuraeffusionens størrelse og identificere evt. forekomst af septae og lokulering (kompliceret parapneumonisk effusion, pleuraempyem, kronisk malign/non-malign effusion). FLUS kan ligeledes benyttes til at identificere det optimale sted for pleuradrænage eller diagnostisk/terapeutisk pleuracentese.
Der findes flere beregninger til udregning af væskemængden, dog er ingen godt valideret og afhænger af patientens respiration og lejring. Desuden skal en procedures fordele og ulemper, hvad enten det drejer sig om anlæggelse af pleuradræn eller pleurapunktur,
altid overvejes og patients symptomer, den kliniske mistanke og øvrige undersøgelser tages i betragtning.
I nedenstående figur ses A) pleuraeffusion med septaedannelse, B) hydropneumothorax, C) pleuraempyem, D) pneumoni med pleuraeffusion og septaedannelse.
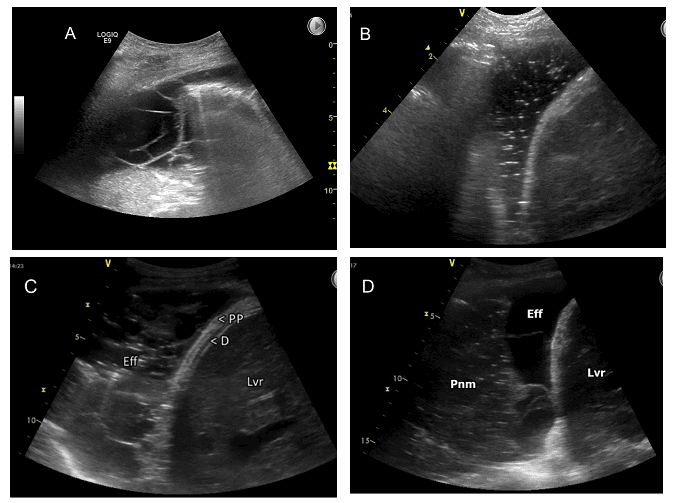
1.9. ANDEN OPLAGT PATOLOGI
Ved FLUS bemærkes tillige tilstedeværelse af anden oplagt patologi, herunder synlige forandringer i selve lungeparenkymet. Nærmere diagnostik og vurdering af disse forandringer falder under den diagnostiske LUS. Nedenstående er derfor simple og generelle beskrivelser af de typiske fund ved relevante tilstande i FLUS-vurdering af den akutte patient.
Forandringer i lungeparenkymet kan visualiseres, når lungevævet ikke indeholder luft men f.eks. væske eller celler. Alt afhængigt af årsag kan de være skarpt eller diffust afgrænset fra det omkringliggende væv og fremtræde både som hypo-, hyper.- og an-ekkoiske strukturer. Oftest ligner forandringerne et solidt organ som f.eks. lever eller milt.
OBS: fravær af synlige forandringer i lungevævet udelukker ikke patologi profund for luftholdigt lungevæv.
1.9.1. Pneumoni
Karakteristiske fund ved pneumoni er forekomsten af et diffust afgrænset hypo- eller hyperekkoisk område, som kan ligne levervæv. I det konsoliderede lungeparenkym ses talrige punktformede eller lineære hyperekkoiske områder repræsenterende luftbronkogrammer. Omkring det synligt konsoliderede områder er der oftest grænse-område, hvor pleuralinjen ses med multiple B-linjer.
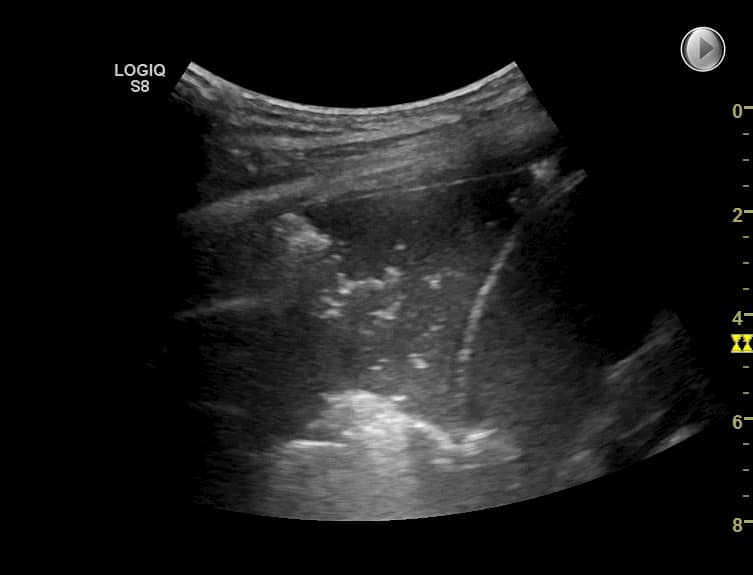
FLUS fund ved pneumoni. Over milten og diaphragma ses en pneumonisk konsolidering svarende til basale del af venstre underlap. Der ses talrige luftbronkogrammer repræsenteret ved spredte hyperekkoiske punktformede områder.
Luftbronkogrammer er et karakteristisk fund ved pneumonisk konsolidering i modsætning til f.eks. lungeemboli eller atelektase [2,8].
1.9.2. Lungeemboli
Hos 75-80 % af patienter med lungeemboli kan LUS påvise perifere forandringer. FLUS forventes at have lavere sensitivitet, da hele thoraxoverfladen ikke skannes systematisk. Lungekonsolidering som følge af en lungeemboli ses ofte som en homogen, hypoekkoisk, rund eller trekantet konsolidering, der er skarpt afgrænset i forhold til det omkringliggende lungevæv (figur). Størrelsen af konsolideringerne varierer fra få millimeter til flere centimeter [4]. Der er ofte en mindre, samsidig pleuraeffusion.
Patientens kliniske fremtræden, symptomer og paraklinik skal altid vurderes samtidig ved fund af en lille konsolidering, som mistænkes for at være en lungeemboli. Desuden kan lungeemboli som sagt ikke udelukkes på baggrund af en FLUS.
1.9.3. Kompressionsatelektase
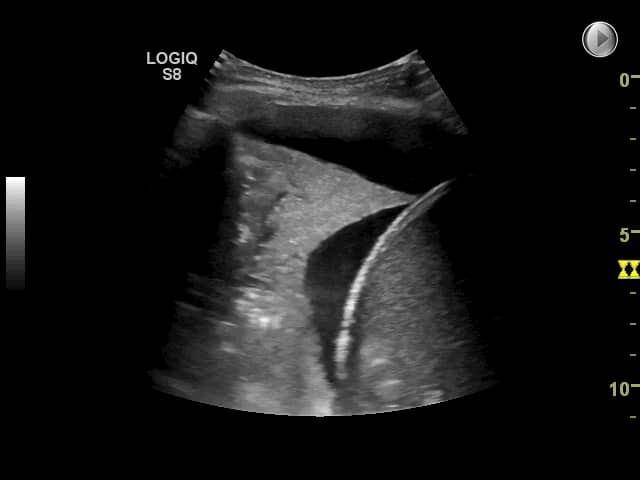
Ved en atelektase er et område af lungeparenkymet tømt for luft, hvilket muliggør visualisering af vævet med ultralyd. Ved kompressionsatelektase (f.eks. atelektase grundet pleuraeffusion) ses en homogen hyperekkoisk konsolidering, oftest uden luftbronkogrammer men nogle gange ses væskebronkogrammer (sorte, aflange strukturer i det konsoliderede lungevæv) [8].
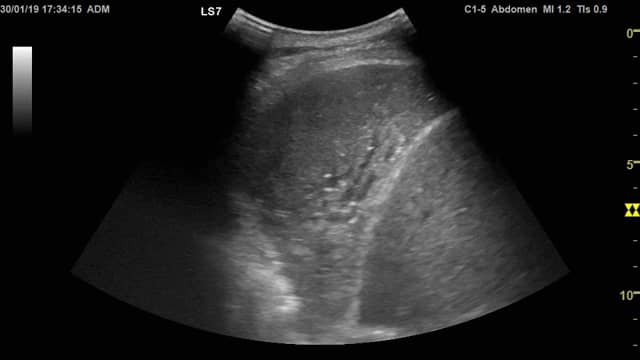
På billedet nedenfor to ses en basal venstresidig atelektase, Strukturen i lungevævet er nærmest identisk med milt-vævet kun adskilt af diafragma (hvid linje). Patienten havde en central tumor som afklemte luftvejene til nederste lungelap, og dette er derfor en obstruktionsatalektase. I atelektasen ses lange, sorte væskebronkogrammer (midt i billedet).
2.0. DOKUMENTATION
Ultralydsklip fra undersøgelsen gemmes på skanner og/eller i dedikeret database. I journal dokumenteres relevante normale og abnorme fund. Af notatet bør fremgå skannede zoner, samt hvilke flader/zoner, det ikke har været mulige at skanne. Ligeledes anføres dikotome fund af de fire fokuserede spørgsmål.
Et eksempel på et notat efter FLUS uden fund af de fire tilstande er:
”Patienten skannet i liggende stilling, anteriore og laterale zoner medskannet. Ingen tegn på interstitielt syndrom, pneumothorax, pleuraeffusion eller anden oplagt patologi.
2.1. UDDANNELSE OG ERFARING
Der er fortsat kun få studier, som belyser omfanget af nødvendig uddannelse for at opnå tilfredsstillende FLUS-kompetenceniveau. Disse studier tyder dog på, at man med et simpelt basiskursus og et begrænset antal superviserede skanninger kan opnå tilfredsstillende teoretiske og praktiske, basale kundskaber. Det anbefales, at uddannelse og certificering i FLUS enten foregår som led i den lungemedicinsk hoveduddannelse (A-kursus) eller ved et af de danske simulationscentre, som har FLUS-kurser godkendt af DLS’ ultralydsudvalg. Uddannelse og certificering i regelret LUS og avanceret LUS bør følge retningslinjer fra det europæiske selskab for diagnostisk ultralyd indtil der foreligger tilsvarende fra DLS / ERS [16]. På lungemedicinske afdelinger bør det være en ultralydsansvarlig læge, der sikrer den faglige standard samt har ansvar for uddannelse, supervision og certificering.
DLS ultralydsudvalg anbefaler ligeledes at der bruges redskaber til løbende kompetencevurderinger og kvalitetssikring, f.eks. LUS-OSAUS [17] eller ACTS skalaen [18].
Link til simulationscentrenes hjemmesider:
TechSim (Odense): http://www.ouh.dk/wm492570
CAMES (København): https://www.regionh.dk/CAMES/Sider/default.aspx
MidtSim (Aarhus): https://www.rm.dk/om-os/organisation/koncern-hr/uddannelse-udvikling-og-arbejdsmiljo/MidtSim/
NordSim (Aalborg): https://aalborguh.rn.dk/for-sundhedsfaglige/uddannelse-kurser-og-kompetenceudvikling/nordsim
Link til European Respiratory Society (ERS) uddannelsesforløb i diagnostisk lungeultralyd:
https://www.ersnet.org/professional-development/thoracic-ultrasound-training-programme
REFERENCER
- Alrajab S, Youssef AM, Akkus NI et al. Pleural ultrasonography versus chest radiography for the diagnosis of pneumothorax: review of the literature and meta-analysis. Crit Care 2013; 17: R208
- Chavez MA, Shams N, Ellington LE et al. Lung ultrasound for the diagnosis of pneumonia in adults: a systematic review and meta-analysis. Respir Res 2014; 15: 50
- Martindale JL, Wakai A, Collins SP et al. Diagnosing Acute Heart Failure in the Emergency Department: A Systematic Review and Meta-analysis. Acad Emerg Med 2016; 23: 223-242
- Squizzato A, Rancan E, Dentali F et al. Diagnostic accuracy of lung ultrasound for pulmonary embolism: a systematic review and meta-analysis. J Thromb Haemost 2013; 11: 1269-1278
- Laursen CB RN, Volpicelli G. ERS Monograph – Thoracic Ultrasound: European Respiratory Society publications; 2018
- Lichtenstein DA. BLUE-protocol and FALLS-protocol: two applications of lung ultrasound in the critically ill. Chest 2015; 147: 1659-1670
- Lichtenstein D. Lung ultrasound in acute respiratory failure an introduction to the BLUE-protocol. Minerva Anestesiol 2009; 75: 313-317
- Volpicelli G, Elbarbary M, Blaivas M et al. International evidence-based recommendations for point-of-care lung ultrasound. Intensive Care Med 2012; 38: 577-591
- Montoya J, Stawicki SP, Evans DC et al. From FAST to E-FAST: an overview of the evolution of ultrasound-based traumatic injury assessment. Eur J Trauma Emerg Surg 2016; 42: 119-126
- Picano E, Frassi F, Agricola E et al. Ultrasound lung comets: a clinically useful sign of extravascular lung water. J Am Soc Echocardiogr 2006; 19: 356-363
- Cortellaro F, Ceriani E, Spinelli M et al. Lung ultrasound for monitoring cardiogenic pulmonary edema. Intern Emerg Med 2017; 12: 1011-1017
- Al Deeb M, Barbic S, Featherstone R et al. Point-of-care ultrasonography for the diagnosis of acute cardiogenic pulmonary edema in patients presenting with acute dyspnea: a systematic review and meta-analysis. Acad Emerg Med 2014; 21: 843-852
- Volpicelli G, Cardinale L, Garofalo G et al. Usefulness of lung ultrasound in the bedside distinction between pulmonary edema and exacerbation of COPD. Emerg Radiol 2008; 15: 145-151
- Pivetta E, Goffi A, Lupia E et al. Lung Ultrasound-Implemented Diagnosis of Acute Decompensated Heart Failure in the ED: A SIMEU Multicenter Study. Chest 2015; 148: 202-210
- Lichtenstein DA, Menu Y. A bedside ultrasound sign ruling out pneumothorax in the critically ill. Lung sliding. Chest 1995; 108: 1345-1348
- EFSUMB. Minimum training requirements for the practice og medical ultrasound in Europe. Appendix 11: Thoracic Ultrasound. . In: (EFSUMB) European Federation of Societies for Ultrasound in Medicine and Biology ed; 2009
- Skaarup SH, Laursen CB, Bjerrum AS et al. Objective and Structured Assessment of Lung Ultrasound Competence. A Multispecialty Delphi Consensus and Construct Validity Study. Ann Am Thorac Soc 2017; 14: 555-560
- Millington SJ, Arntfield RT, Guo RJ et al. The Assessment of Competency in Thoracic Sonography (ACTS) scale: validation of a tool for point-of-care ultrasound. Crit Ultrasound J 2017; 9: 25