1.1 AFGRÆNSNING
Denne retningslinje omhandler udførelse af endoskopisk ultralydsundersøgelse til mediastinal staging ved erkendt eller mistænkt lungecancer.
Endoskopisk ultralydsundersøgelse på andre indikationer er ikke inddraget i denne retningslinje.
1.2 DEFINITIONER
EBUS: Endobronkial ultralydsundersøgelse
Endosonografi: Kombineret EBUS og EUS-(B)
ERS: European Respiratory Society
ESGE: European Society of Gastrointestinal Endoscopy
ESTS: European Society of Thoracic Surgery
EUS: Endoskopisk øsofageal ultralyd med gastrointestinalt (GI) skop
EUS-B: Endoskopisk øsofageal ultralyd med EBUS skop
EUS-(B): Endoskopisk øsofageal ultralyd med EUS skop eller EBUS skop
Mediastinoskopi: Inddeles i cervikal mediastinoskopi, hvor station 2, 4, 7 og 10 kan biopteres, og udvidet (extended) cervikal mediastinoskopi, hvorved station 5 og 6 kan nås
NSCLC: Ikke-småcellet lungecancer
PET-CT: Integreret computed og F18-fluorodeoxyglucose positron emission tomografi
Tabel 1. N-klassifikation (8. udgave)
| Nx | De regionale lymfeknuder kan ikke vurderes |
| N0 | Ingen regional lymfeknudemetastase |
| N1 | Metastase til ipsilaterale peribronchiale og/ eller ipsilaterale hilære og intrapulmonale lymfeknuder |
| N2 | Metastase til ipsilaterale mediastinale og/eller subkarinale lymfeknuder |
| N3 | Metastase til kontralaterale mediastinale og/eller hilære, ipsilaterale eller kontralaterale skalener eller supraklavikulære lymfeknuder |
Hvis der påvises NSCLC, er TNM-klassifikation afgørende for behandlingsmulighederne. Kirurgi er som hovedregel i Danmark ikke mulig, hvis der påvises N2- eller N3-sygdom. I så fald skal patienten henvises til stråle- og kemoterapi, eventuelt med kurativt sigte.
1.3 MEDIASTINUM
Den primære CT-skanning giver den første vurdering af en eventuel lungetumors stadie og kan vejlede den videre udredningsstrategi. I beskrivelsen af mediastinum på CT skal forstørrede lymfeknuder anføres i cm på korteste diameter.
Der skal anvendes Mountain-Dresslers klassifikation fra 1997 (Chest 1997) med senere modifikationer i 2009 (Rush 2009). Det fremgår heraf, at den mediastinale midtlinie på niveau af lymfeknudestationer 2 og 4 ligger sv.t. tracheas venstre rand. Grænsen mellem station 4L og 10L er overkanten af venstre pulmonalarterie, mens grænsen mellem station 4R og 10R er underkanten af v. azygos, som kendetegnes ved at munde ud i v. cava superior.
1.4 MEDIASTINAL STAGING
En nøjagtig mediastinal staging er afgørende for planlægning af optimal behandling. Den mediastinale staging baserer sig på en kombination af billeddiagnostik og endoskopiske modaliteter eller kirurgiske procedurer (mediastinoskopi / VATS).
I dag er endosonografi førstevalg til invasiv mediastinal staging, da proceduren er minimal invasiv, sikker og veltolereret, kan udføres i moderat sedation, forbedrer den nodale staging, reducerer behovet for torakotomier og er cost-effective.
Den kontrastforstærkede CT-skanning af thorax og øvre abdomen kan ikke stå alene i forhold til en præcis mediastinal staging grundet lav sensitivitet (55 %) og specificitet (81 %) (Silvestri / ACCP 2013).
PET-CT er mere præcis til at stadieinddele lungecancer end CT, men de to billedmodaliteter komplementerer hinanden. Et fokus med patologisk øget FDG-optagelse tyder på malignitet, men er ikke specifikt, hvorfor et positivt PET-fund også altid skal følges op med invasiv diagnostik eller anden billeddiagnostik.
Den negative prædiktive værdi med hensyn til mediastinum er høj ved PET-CT, men vigtige undtagelser er:
1) Mistanke om N1 sygdom ved CT og/eller PET-CT (forstørrede lymfeknuder over 8-10 mm og/eller suspekt FDG-optagelse)
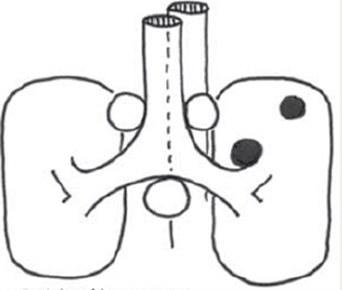
2) Primærtumor er PET-negativ
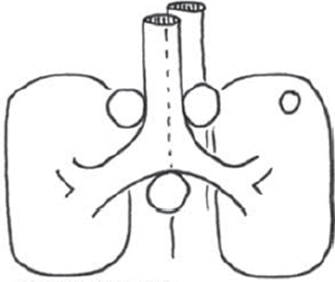
3) Primærtumor er over 3 cm (med eller uden FDG-optagelse)
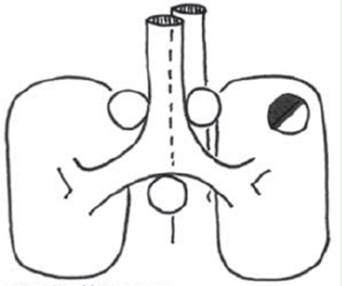
4) Central tumor uanset størrelse
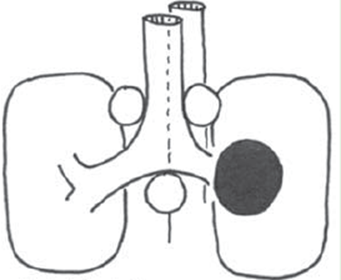
Ved disse forhold – hvor N ved PET-CT tilsyneladende er N0/N1 – viser evidens / studier, at der er risiko på 6-30 % for at der er N2/N3 sygdom (Hishida 2008, Naur 2017).
Den kombinerede negative prædiktive værdi af CT og PET-CT (”dobbelt-negativt” mediastinum) for metastasering til mediastinum ved perifer lungetumor (yderste 1/3) er 94 % for tumorstørrelse < 3 cm og 89 % for tumorstørrelse > 3 cm (Wang 2012, Vilmann 2015). Risikoen for spredning til mediastinum er desuden øget, når der er tale om adenocarcinom og høj FDG-optagelse i primærtumor.
Studier viser, at kirurgisk staging bør udføres, når et af punkt 1-4 er opfyldt (især punkt 1), og når EBUS / EUS-(B) ikke kan påvise malignitet.
Lymfeknudeforstørrelse ved CT / PET-CT og / eller abnorm FDG-optagelse svarende hertil kan ikke alene benyttes til at konkludere sygdom i mediastinum, men skal efterfølges af sampling fra de respektive lymfeknuder i det omfang, det er teknisk muligt.
1.4.1. Endoskopisk ultralydsundersøgelse
Man kan udføre endoskopisk ultralydsundersøgelse på følgende vis:
1) EBUS: Anvendelse af EBUS-skopet via trachea
2) EUS-B: Anvendelse af EBUS-skopet via øsofagus
3) EUS: Anvendelse af GI-skop via øsofagus
4) Endosonografi: Kombineret EBUS og EUS-(B)
Procedurerne kan både enkeltvis og i kombination udføres i ambulant regi i lokalbedøvelse og moderat sedation.
Ingen enkeltprocedure i mediastinum kan nå alle lymfeknudestationer:
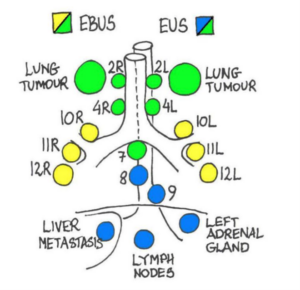
Som det fremgår af ovenstående, er EBUS og EUS/EUS-B komplementære undersøgelser, hvorved en komplet gennemgang af mediastinum muliggøres.
1.4.2 Specielt om EUS-(B):
EUS-(B) supplerer EBUS, idet der kan fås adgang til strukturer, som ikke kan nås ved konventionel EBUS.
EUS-(B) kan anvendes som selvstændig planlagt undersøgelse i et udredningsprogram, eller som supplement til planlagt igangværende EBUS, hvor ultrasonografisk imaging ikke er optimalt ved EBUS, eller når patienten har svært ved at acceptere EBUS-skopet i trachea.
Fordele ved EUS-(B):
- Ingen hoste
- Ingen bruskringe, som er i vejen for nålen ved sampling
- Mulighed for at bioptere øsofagusnære lunge- og pleuratumorer, som ikke er tilgængelig ved EBUS
- Mulighed for at bioptere nedre paraøsofageale strukturer samt strukturer under diaphragma
- Mulighed for at visualisere pleura på begge sider, og dermed adgang til aspiration af pleuraeffusion i udvalgte tilfælde
Følgende strukturer kan nås ved EUS-(B):
- Øsofagusnære lunge- og pleuratumorer
- Mediastinale lymfeknuder ved station 3P, 1L, 2L, 4L, station 7 samt station 8 og 9
- Strukturer under diaphragma (fx retroperitoneale lymfeknuder, tumorer / metastaser i venstre leverlap, pancreas og venstre binyre)
Endosonografi med et eller to endoskoper?
En komplet endosonografisk mediastinal staging kan udføres med et EBUS-skop via både trachea og øsofagus (EUS-B). Alternativt kan sidstnævnte undersøgelse foregå med et dedikeret GI-skop (EUS). Argumentet for at anvende to forskellige endoskoper til henholdsvis EBUS og EUS er langt overvejende begrundet i fordelene ved et dedikeret GI-skop, hvor ultralydbilledets vinkel er større (150– 180 versus 50–60 grader), og billedet er bedre og skarpere ved EUS end ved EUS-B. EUS-skopet er tillige længere, mere stabilt og har dermed en større rækkevidde under diafragma. Der er også mulighed for at styre kanylen i den ønskede retning takket været en såkaldt ”elevator”.
Den største ulempe ved EUS–skopet er, at skopet er stort, skal skiftes undervejs og er kun anvendeligt via oral adgang. Der kan således være øget tidsforbrug forbundet med anvendelse af to endoskoper ved samme procedure. Mange lungemedicinere finder det i praksis nemmere at udføre ultralydsundersøgelse i øsofagus med EBUS-skopet, og al nuværende tilgængelig evidens har vist, at det både er sikkert at udføre, og har stor diagnostisk gevinst uden nævneværdige komplikationer.
Endosonografiske protokoller:
Endosonografi udføres med forskellig metodik, alt efter hvilket formål undersøgelsen har.
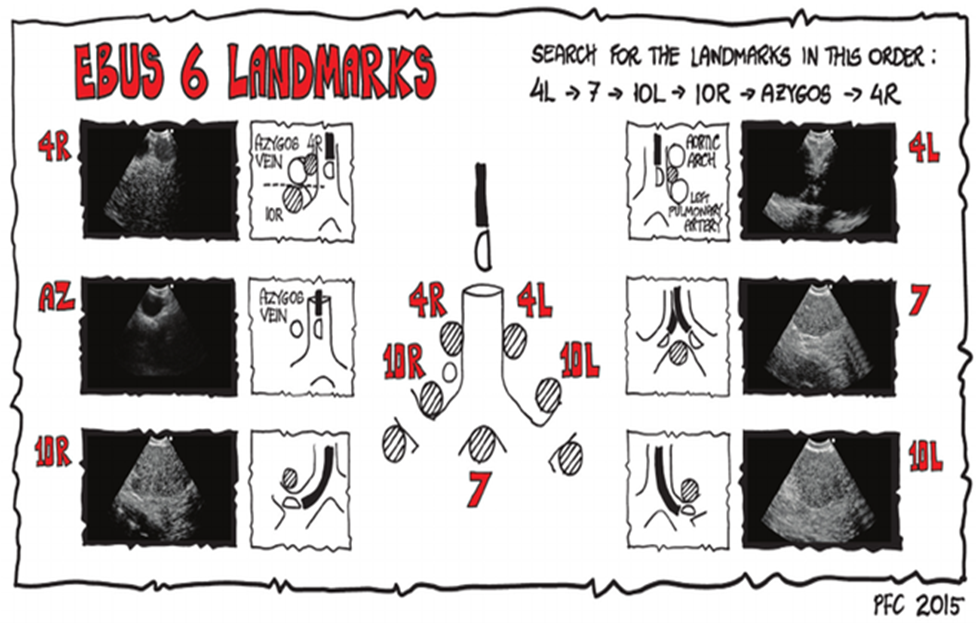
Systematisk EBUS / EUS-(B) (staging og evt. diagnose):
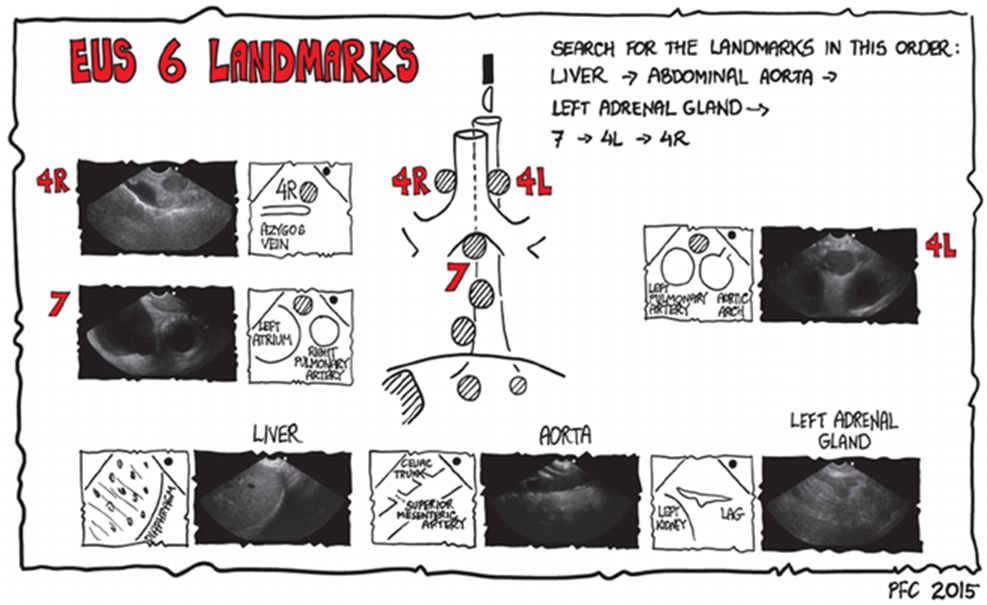
- Systematisk gennemgang i hht. protokol (ERS – se figurer under uddannelse og certificering)
- Såvidt muligt sampling fra station 4L, 7 & 4R
- Sampling fra abnorm FDG-optagende lymfeknuder ved PET-CT
- Sampling fra ultrasonografisk abnormt udseende lymfeknuder
- Sampling fra FDG-optagende og/eller forstørret venstre binyre
- sampling fra primærtumor eller øvrige metastaser hvis muligt
Targeteret EBUS (evt. med EUS-(B)) (til diagnose ved inkurabel sygdom):
- Systematisk gennemgang i hht. protokol (ERS – se figurer under uddannelse og certificering)
- Sampling fra abnormt FDG-optagende lymfeknuder ved PET-CT
- Sampling fra ultrasonografisk abnormt udseende lymfeknuder
- Sampling fra FDG-optagende og/eller forstørret venstre binyre
- sampling fra primærtumor eller øvrige metastaser hvis muligt
Fokuseret / hit and run EBUS og / eller EUS-(B) (hurtig undersøgelse til diagnose):
- Sampling fra et eller få abnorm FDG-optagende lymfeknude(r) / malignitetssuspekte strukturer ved PET-CT
1.5 MEDIASTINAL STAGING I HENHOLD TIL ESGE / ERS / ESTS GUIDELINES 2015
1.5.1 Kombinér EBUS og EUS-(B):
Hos patienter hvor der er mistanke om eller som er diagnosticeret med NSCLC, og som har forstørrede eller PET-positive lymfeknuder i mediastinum / hili ved CT og/eller PET-CT, er endosonografi (EBUS og EUS-(B)) førstevalg som initiale undersøgelse i forhold til kirurgisk staging. I et systematisk review og meta-analyse (Korevaar et al. 2016) blev den diagnostiske sensitivitet øget med 22 %, når EBUS blev kombineret med EUS-(B) og 12 % når EUS-(B) blev kombineret med EBUS. Endosonografi med kombination af EBUS og EUS-(B) er derfor at foretrække fremfor EBUS alene. Hvis kombination af EBUS og EUS-(B) ikke er til rådighed, da må EBUS betragtes som acceptabel enkeltstående undersøgelse
1.5.2. Hvornår er det obligatorisk at udføre mediastinal staging:
Hos patienter hvor der er mistanke om eller er diagnosticeret med perifer NSCLC, anbefales det, at EBUS eller/og EUS-(B) bør udføres før behandling, hvis en eller flere af følgende forhold gøre sig gældende:
1) Forstørrede eller PET-positive ipsilaterale lymfeknuder
2) Primærtumor er uden FDG-optagelse
3) Primærtumor ≥ 3 cm eller central primærtumor (inderste 2/3)
Hos patienter med centralt lokaliseret mistænkt eller diagnosticeret NSCLC uden tegn på mediastinal eller hilær involvering ved billeddiagnostik (CT og/eller PET-CT), anbefales at foretage EBUS og/ eller EUS-(B) frem for kirurgisk staging (Korevaar 2017, Steinfort 2017). Lungetumorer tæt på øsofagus og de centrale luftveje kan biopteres med henholdsvis EUS-(B) og EBUS med en sensitivitet på henholdsvis 88-100 % og 82-91 %, og er specielt nyttigt i tilfælde, hvor tumor ikke er tilgængelig ved bronkoskopi.
Endosonografi tillader endvidere også visualisering af mulig invasion af en central tumor i de store kar, f.eks. pulmonalarterier og hjertet. Evidensen for metodens pålidelighed sammenlignet med PET-CT er endnu begrænset. Men det er vist, at EUS kombineret med CT til vurdering af centrale tumorer gav øget sensitivitet og negativ prædiktiv værdi for om tumor var T4 (Kuijvenhoven 2017).
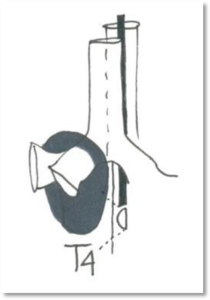
Der anbefales komplet og systematisk undersøgelse af de mediastinale og hilære lymfeknuder, og som minimum sampling af de centrale lymfeknudestationer (4L, 7 & 4R) foruden de abnorme (forstørrede eller PET-positive) lymfeknuder hos patienter med NSCLC og abnormt mediastinum ved CT eller PET-CT.
Hos patienter som har en centralt lokaliseret lungetumor, som ikke er synlig ved konventionel bronkoskopi, anbefales det at udføre endosonografi, såfremt tumoren er lokaliseret klods op ad de store luftveje (EBUS) eller øsofagus (EUS-(B)).
Hvis endosonografi ikke påviser malign nodal involvering, anbefales mediastinoskopi, især ved mistanke om N1 sygdom. Reelt set udføres mediastinoskopi dog i dag meget sjældent i Danmark. Oftest vil man i stedet på MDT diskutere, om der skal gøres re-endosonografi.
Ved behov for mediastinal nodal re-staging efter neoadjuverende behandling, anbefales at udføre EBUS og/eller EUS-(B) til detektering af persisterende nodal sygdom. Ved manglende afklaring / negativ undersøgelse, anbefales supplerende kirurgisk staging.
Hos patienter, som mistænkes for at have metastase til venstre binyre, anbefales det at udføre endoskopisk finnålsaspiration (EUS-(B)-FNA).
1.5.3. Hvornår kan mediastinal staging udelades:
Hos patienter med mistænkt / påvist NSCLC, hvor primærtumor er under 3 cm og er perifert beliggende (i lungens yderste 1/3), og hvor mediastinum ikke er abnorm ved hverken CT og/eller PET-CT (”dobbelt-negativ”), kan mediastinal udredning udelades (under 6 % risiko for mediastinal metastasering), og sagen kan medtages på MDT med henblik på initiering af behandling, når der er opnået diagnostisk afklaring af primærtumor.

1.5.4. Rækkefølge for sampling
Der skal altid biopteres fra det højeste stadie (rækkefølge: evt. M1c -> M1b -> N3 -> N2 -> N1 -> evt. primærtumor) for ikke at kontaminere biopsiudstyret og dermed stadieinddele højere end det korrekte med færre behandlingsmuligheder til følge (fx operation).
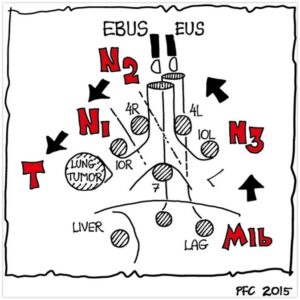
Ved skift fra EBUS til EUS-B under en procedure, bør biopsiudstyret skiftes, hvis der i forbindelse med EBUS er biopteret fra lymfeknuder med højere N-stadie. Ligeledes anbefales skift af biopsiudstyr ved sampling fra venstre binyre eller andre strukturer under diafragma.
Af infektionshygiejniske årsager må der i en seance ikke udføres først EUS-B og derefter EBUS med samme endoskop.
1.6 UDDANNELSE OG CERTIFICERING
Til optimal endosonografisk staging af lungecancer, anbefales det, at operatøren både er trænet i EBUS og EUS-(B). Således kan en komplet endoskopisk staging kan udføres i én session.
Det anbefales, at nye kursister i endosonografi følger et struktureret træningscurriculum, som består af simulationsbaseret træning (f.eks. det nationale EBUS-kursus, som udbydes på de store universitetshospitaler i Danmark eller det europæiske ERS-kursus i EBUS) efterfulgt af superviserede procedurer på patienter. Der findes i skrivende stund endnu ikke et dedikeret EUS-(B) kursus i Danmark eller Europa grundet manglende modul i de eksisterende simulatorer på markedet. Der anbefales derfor fortsat træning heri via mesterlæreprincippet.
Det anbefales, at kompetencer i EBUS og EUS-(B) til lungecancer staging skal vurderes med tilgængelige og validerede vurderingsværktøjer.
1.7 REFERENCER:
- Annema JT, Veseliç M, Rabe KF. EUS-guided FNA of centrally located lung tumours following a non-diagnostic bronchoscopy. Lung Cancer. 2005 Jun;48(3):357-61
- Annema JT, van Meerbeeck JP, Rintoul RC, Dooms C, Deschepper E, Dekkers OM, et al. Mediastinoscopy vs endosonography for mediastinal nodal staging of lung cancer: a randomized trial. JAMA 2010 Nov 24; 304(20):2245-52
- Bødtger U, Vilmann P, Clementsen P, Galvis E, Bach K, Guldhammer Skov B. Clinical Impact of Endoscopic Ultrasound – Fine Needle Aspiration of Left Adrenal Masses in Established or Suspected Lung Cancer. J Thorac Oncol 2009; 4(12): 1485-9
- Crombag LMMJ, Szlubowski A, Stigt JA, Schuurbiers O, Korevaar DA, Bonta PI, et al.: EUS‑B-FNA vs conventional EUS-FNA for left adrenal gland analysis in lung cancer patients. Lung Cancer 2017;108:38–44.
- Detterbeck FC, Boffa DJ, Kim AW, Tanoue LT. The Eighth Edition Lung Cancer Stage Classification. Chest. 2017; 151(1):193-203.
- Dansk Lunge Cancer Gruppe (DLCG) guideline december 2023. Lungecancer. Visitation, diagnose og stadieinddeling. http://lungecancer.dk/documents/9A5E8A41- C54D-4F79-B16A-EE645900D166.pdf
- Fritscher-Ravens A, Bohuslavizki KH, Brandt L et al. Mediastinal lymph node involvement in poten- tially resectable lung cancer: comparison of CT, positron emission tomography, and endoscopic ultrasonography with and without fine-needle aspira- tion. Chest 2003; 123: 442-451.
- Gu P, Zhao YZ, Jiang LY, Zhang W, Xin Y, Han BH. Endobronchial ultrasound-guided transbronchial needle aspiration for staging of lung cancer: a systematic review and meta-analysis. Eur J Cancer. 2009 May;45(8):1389-96.
- Herth FJ, Krasnik M, Kahn N, Eberhardt R, Ernst A. Combined endoscopic-endobronchial ultrasound-guided fine-needle aspiration of mediastinal lymph nodes through a single bronchoscope in 150 patients with suspected lung cancer. Chest. 2010 Oct; 138(4):790-4.
- Hishida T, Yoshida J, Nishimura M, Nishiwaki Y, Nagai K. Problems in the current diagnostic standards of clinical N1 non-small cell lung cancer. Thorax 2008;63:526–31.
- Hwangbo B, Lee GK, Lee HS, Lim KY, Lee SH, Kim HY, Lee HS, Kim MS, Lee JM, Nam BH, Zo JI. Transbronchial and transesophageal fine-needle aspiration using an ultrasound bronchoscope in mediastinal staging of potentially operable lung cancer. Chest. 2010 Oct;138(4):795-802.
- Jenssen C, Annema JT, Clementsen P, Cui X-W, Borst MM, Dietrich CF: Ultrasound techniques in the evaluation of the mediastinum, part 2: mediastinal lymph node anatomy and diagnostic reach of ultrasound techniques, clinical work up of neoplastic and inflammatory mediastinal lymphadenopathy using ultrasound techniques and how to learn mediastinal endosonography. J Thorac Dis 2015;7:E439-58.
- Korevaar DA, Crombag LM, Cohen JF, Spijker R, Bossuyt PM, Annema JT: Added value of com- bined endobronchial and oesophageal endoso- nography for mediastinal nodal staging in lung cancer: a systematic review and meta-analysis. Lancet Respir Med 2016;4:960–968.
- Korevaar DA, Colella S, Spijker R, Bossuyt PM, Konge L, Clementsen PF, Annema J. Esophageal endosonography for the diagnosis of intrapulmonary tumors: A systematic review and a meta-analysis. Respiration 2017; 93:126 – 137.
- Kuijvenhoven JC, Crombag L, Breen DP, van den Berk I, Versteegh MIM, Braun J, Winkelman T, van Boven W, Bonta PI, Rabe KF, Annema JT. Esophageal ultrasound (EUS) assessment of T4 status in NSCLC patients. Lung Cancer. 2017;114:50-55.
- Lococo F, Cesario A, Attili F, Chiappetta M, Leuzzi G, Costamagna G, Granone P, Larghi A. Transesophageal endoscopic ultrasound-guided fine-needle aspiration of Pleural Effusion for the staging of non-small cell lung cancer. Interactive Cardiovascular and Thoracic Surgery 2013;17(2):237-241.
- Lv YL , Yuan DM, Wang K, Miao XH, Qian Q, Wei SZ, Zhu XX, Song Y. Diagnostic performance of integrated positron emission tomography/computed tomography for mediastinal lymph node staging in non-small cell lung cancer: a biva- riate systematic review and metaanalysis. J Thorac Oncol. 2011 Aug;6(8):1350-8
- Mountain CF. Revisions in the international system for staging lung cancer. Chest 1997; 111:1710-17
- Naur TMH, Konge L, Clementsen PF. Endobron- chial Ultrasound-Guided Transbronchial Needle Aspiration for Staging of Patients with Non-Small Cell Lung Cancer without Mediastinal Involvement at Positron Emission Tomography-Computed Tomography. Respiration. 2017; 94:279-284.
- Nguyen P, Feng JC, Chang KJ. Endoscopic ultra- sound (EUS) and EUS-guided fine-needle aspira- tion (FNA) of liver lesions. Gastrointest Endosc. 1999 Sep; 50(3):357-61.
- Silvestri GA, Gonzalez AV, Jantz MA , Margolis ML, Gould MK, Tanoue LT, Harris LJ, & Detterbeck FC. Methods for Staging Non-small Cell Lung Cancer. Diagnosis and Management of Lung Cancer, 3rd ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. CHEST 2013; 143(5)(Suppl):e211S–e250S
- Tournoy KG, Rintoul RC, van Meerbeeck JP, Carroll NR, Praet M, Buttery RC, van Kralingen KW, Rabe KF, Annema JT. EBUS-TBNA for the diagnosis of central parenchymal lung lesions not visible at routine bronchoscopy. Lung Cancer. 2009 Jan;63(1):45-9.
- Verma A, Jeon K, Koh WJ, Suh GY, Chung MP, Kim H, Kwon OJ, Um SW. Endobronchial ultra- sound-guided transbronchial needle aspiration for the diagnosis of central lung parenchymal lesions. Yonsei Med J. 2013 May 1;54(3):672-8.
- Vilmann P, Clementsen PF, Colella S, Siemsen M, De Leyn P, Dumonceau J, Herth FJ, Larghi A, Vasquez-Sequeiros E, Hassan C, Crombag L, Korevaar DA, Konge L, Annema JT. Combined endobronchial and esophageal endosonography for the diagnosis and staging of lung cancer: European Society of Gastrointestinal Endoscopy (ESGE) Guideline, in cooperation with the European Respiratory Society (ERS) and the European Society of Thoracic Surgeons (ESTS). Endoscopy 2015; 47:545-559
- Wang J, Welch K, Wang L, Kong F-M. Negative predictive value of positron emission tomography for stage T1-2 N0 non-small-cell lung cancer: a meta-analysis. Clin Lung Cancer 2012;13:81–9.
- Zhang R, Ying K, Shi L, Zhang L, Zhou L. Combined endobronchial and endoscopic ultrasound-guided fine needle aspiration for mediastinal lymph node staging of lung cancer: a meta- analysis. Eur J Cancer. 2013 May;49(8):1860-7.
