1.1. DEFINITION
Interstitielle lungesygdomme (ILS) er en heterogen gruppe af lungesygdomme, som kan opstå sekundært til miljøpåvirkning, underliggende autoimmun sygdom eller ukendte årsager. ILS kan udvikles som følge af inflammation med efterfølgende fibrosedannelse (arvævsdannelse) eller alene ved fibrose. Idiopatisk pulmonal fibrose (IPF) er den hyppigst forekommende arketype på fibrotisk ILS (se DLS retningslinjen for ”Idiopatisk pulmonal fibrose”), men andre undertyper af ILS kan præsentere sig med progredierende fibrose på HRCT af thorax i kombination med tiltagende symptomer, faldende lungefunktion og dårlig prognose, helt som IPF. Denne fænotype kaldes progressiv fibrotisk ILS (PF-ILS). PF-ILS er ikke en selvstændig sygdomsenhed men en heterogen gruppe af ILS, der fænotypisk præsenterer sig med varierende grad a lungefibrose og inflammation.
1.2. FOREKOMST
Incidensen af PF-ILS, er svær at vurdere, men det skønnes, at ca. 60-80 nye patienter årligt vil udvikle PF-ILS. Dette antal forventes at stige pga. den forventede øgede opmærksomhed på mulig behandling (se senere).
1.3. ÆTIOLOGI
PF-ILS dækker over flere ILS-typer, og har således forskellig underliggende ætiologi for fibroseudvikling (figur 1). De hyppigste typer, udover IPF, er pulmonal manifestation af autoimmune sygdomme, hvor reumatoid artritis og sklerodermi har højest prævalens af associeret ILS, non-IPF idiopatiske interstitielle pneumonier (IIP), hypersensitivitetspneumonitissamt sarkoidose og pneumokonioser. Et fælles patofysiologisk træk er, at alle subtyper præsenterer sig med varierende grader af lungefibrose.
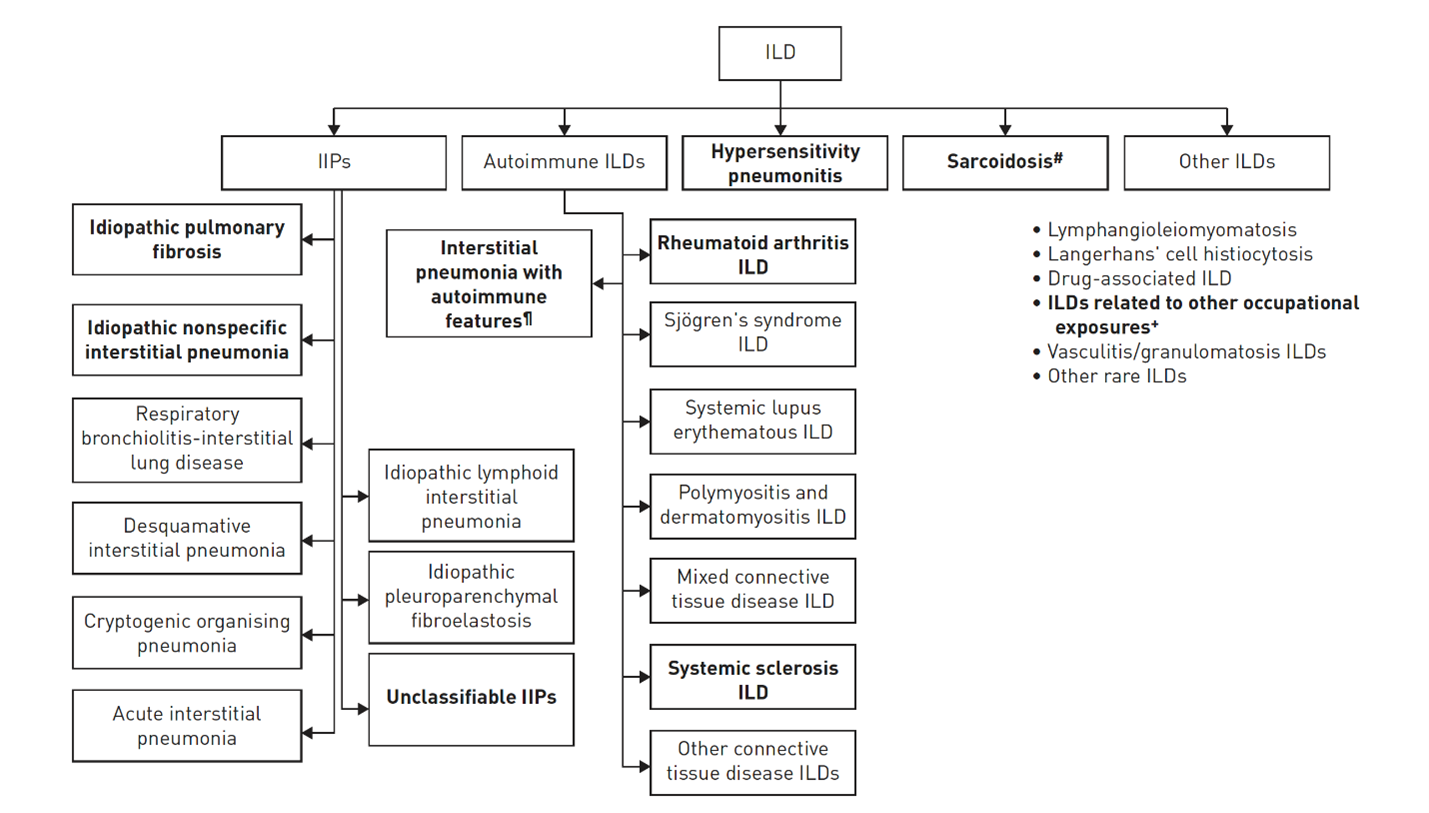
Figur 1: De sort markerede sygdomskategorier er dem der kan udvikle sig til PF-ILS (Cottin V et al. Eur Respir Rev 2018;27:180076). # Stadie IV sarkoidose. ¶ Ikke en etableret klinisk diagnose. + F.eks. asbestose og silikose.
1.4. SYMPTOMER OG KLINISKE FUND
Som for andre ILS er de mest almindelige symptomer dyspnø og hoste, som forværres over tid (måneder til år). Objektivt kan der ses clubbing i relation til enkelte PF-ILS subtyper (som f.eks. ved IPF), men også hypoxæmi, der igen kan medføre pulmonal hypertension med udvikling af deklive ødemer. Lungestetoskopisk vil man kunne høre velcrokrepitation. Endvidere vil man hos de patienter der har en underliggende autoimmun gigtsygdom ofte kunne identificere ekstrapulmonale symptomer fra bl.a. hud, led, slimhinder, muskler, øjne, og tåre- og spytkirtler.
1.5. UDREDNING
PF-ILS medfører gradvis forværring af respiratoriske symptomer, faldende lungefunktion og tiltagende fibrose på HRCT-skanning. Patienter med PF-ILS vil derfor som oftest allerede have kontrolforløb på et af de højtspecialiserede ILS-centre lige så vel, som afklaring af underliggende ætiologi vil være kendt. I enkelte tilfælde kan en patient naturligvis debutere med subjektive og objektive fund forenelig med PF-ILS, men ikke nødvendigvis opfylde kriterier for antifibrotisk behandling (se afsnit 1.6.2).
Patienter med PF-ILS vil være eller anbefales udredt med samme tilgang, som skitseret i DLS retningslinjen for ”Interstitielle lungesygdomme” (se venligst denne), og består i korte træk af specifik anamnese, udvidet lungefunktionsundersøgelse 6 min. gangtest (6MWT) og HRCT af thorax. Behov for evt. invasiv diagnostik vurderes individuelt, oftest først med transbronkial cryobiopsi og BAL, evt. kirurgisk lungebiopsi. En gruppe af patienter med PF-ILS vil have behov for afklaring af anden relevant ætiologi, sammenhæng eller komorbiditet ved supplerende undersøgelser hos arbejdsmedicinere, reumatologer og kardiologer (f.eks. TTE).
1.6. BEHANDLING
Den farmakologiske behandling baserer sig på:
- Antifibrotisk behandling med nintedanib (se senere)
- Behandling af evt. underliggende sygdom (f.eks. autoimmune gigtsygdomme) med bl.a. antiinflammatorisk behandling med glukokortikosteroider og immunsuppression. Evt. kombinationsbehandling med immunsuppression og antifibrotisk behandling besluttes individuelt evt. ved MDT.
1.6.1 Nintedanib (Ofev®) og effektmål
Nintedanib (Ofev®) er en tyrosinkinasehæmmer med affinitet til en række celleoverfladereceptorer, inkl. trombocytderiverede vækstfaktorreceptor (PDGFR) α og β, fibroblast vækstfaktorreceptor (FGFR) 1-3 og vaskulær endotelial vækstfaktorreceptor (VEGFR) 1-3. Ved binding til PDGFR og FGFR blokeres receptorernes intracellulære signalveje, og derved hæmmes proliferation, migration og differentiering af lungefibroblaster og videre udvikling af lungefibrose.
Mortalitet af PF-ILS korrelerer i høj grad med fald i FVC som følge af progression af lungefibrosen. Behandlingsmålet er derfor opbremsning af sygdomsudvikling med henblik på uforandret status eller reduceret progressionshastighed. I INBUILD studiet blev patienter med PF-ILS randomiseret til behandling med nintedanib 150 mg x 2 dagligt vs. placebo i 52 uger. Studiet viste, at patienter behandlet med nintedanib havde reduceret sygdomsprogression målt ved et reduceret FVC-fald på mellem 107-128 ml pr. år sammenlignet med placebogruppen. Studiet kunne ikke vise signifikante forskelle i dødelighed, livskvalitet eller tiden til exacerbation, men var heller ikke designet til at undersøge mortalitet.
1.6.2 Indikation for behandling med nintedanib
Som udgangspunkt skal patienter være diagnosticeret med fibrotisk ILS.
I henhold til Medicinrådets anbefaling kan patienter med PF-ILS tilbydes behandling med nintedanib, hvis de har progression trods behandling med immunmodulerende lægemidler eller udvikling af uacceptable bivirkninger. For en selekteret mindre gruppe af patienter med progressiv fibrose, som har overvejende fibrotisk sygdom uden betydelig inflammation bedømt på HRCT +/- patologi, er det oplagt, at nintedanib kan anvendes som førstelinjebehandling.
Følgende progressionskriterier skal være opfyldt inden for de sidste 24 måneder på trods af evt. standardbehandling:
- Relativt fald i FVC (% af forventet) ≥10 %
- Relativt fald i FVC (% af forventet) på 5 til <10 % OG forværret fibrose på HRCT
- Relativt fald i FVC (% af forventet) på 5 til <10 % OG forværrede symptomer
- Forværrede symptomer* OG forværret fibrose på HRCT
*Anden årsag til forværrede respiratoriske symptomer skal udelukkes.
1.6.3 Dosering med nintedanib
Kapsel Ofev® findes i doser sv.t. 100 mg og 150 mg.
Opstartsdosering sv.t. kapsel Ofev®150 x 2 dagl., og ved bivirkninger (se afsnit 1.6.5) med mulighed for dosisreduktion til 100 mg x 2 dagl.
1.6.4 Indikation for behandlingsophør med nintedanib
Medicinrådet har besluttet, at der skal være stopkriterier for behandling med nintedanib. Behandlingen skal således seponeres hvis flg. kriterier opfyldes:
- Gennemført lungetransplantation
- Kronisk lungesvigt (behov for døgn-ilttilskud) og dårlig performansstatus 3 eller 4
- FVC-fald på samlet set >10% i løbet af ét år (målt ved 3 uafhængige målinger), trods stabilt indtag af nintedanib
1.6.5 Bivirkninger og håndtering ved nintedanib
Bivirkningerne er dosisafhængige. Kapsler skal indtages med mad, synkes hele med vand og må ikke tygges eller knuses. Målet med nintedanib behandling er, at flest mulige ptt. tager maksimal dosis pga. dosis-effekt sammenhængen. Dosis modificeres afhængig af bivirkninger (tilråd f.eks. indtag sammen med mad). Hvis nintedanib stoppes, så forsøg at genoptage behandlingen, evt. lidt langsommere og overvej altid, om bivirkningen er associeret til nintedanib eller evt. til noget andet.
GI-bivirkninger
De hyppigste bivirkninger er abdominalsmerter, diarré, kvalme, nedsat appetit, vægttab, opkastning og leverpåvirkning.
Håndtering af GI-bivirkninger
Diarré
- Instruér ptt. i, at diarré er en hyppig, men oftest mild bivirkning. Ved diarré påbegyndes loperamid og rehydrering.
- Stop evt. laksantia.
- Ved fortsatte symptomer dosisreduktion til 100 mg x 2, med efterfølgende stigning til den maksimalt tolererede dosis.
- Ved fortsatte symptomer trods dosisreduktion gøres 2 ugers behandlingspause, herefter genoptages behandlingen (100 mg x 2).
Kvalme
- Kvalme/opkastninger: Påbegynd anti-emetika.
- Ved fortsatte symptomer dosisreduktion til 100 mg x 2, med efterfølgende stigning til den maksimalt tolererede dosis.
- Ved fortsatte symptomer gøres 2 ugers behandlingspause, herefter genoptages behandlingen (100 mg x 2).
Leverpåvirkning
- Ved ALAT-forhøjelse > 3 af øvre grænse for normalområdet skal man søge at udelukke andre årsager, herunder anden medicin og alkohol.
- Ved vedvarende ALAT forhøjelse reduceres dosis til 100 mg x 2 eller behandlingen pauseres indtil normale levertal.
- Behandlingen genoptages herefter med 100 mg x 2 med evt. senere dosisøgning.
- Ved ALAT ≥ x 3 og samtidige symptomer på nedsat leverfunktion seponeres nintedanib uden genoptagelse.
1.6.6 Kontraindikationer for behandling med nintedanib
Nogle patienter må ikke få nintedanib. Det drejer sig om patienter med:
- Svært nedsat lever- og nyrefunktion, herunder dialyse
- Allergi overfor jordnødder eller soja
- Abdominal kirurgi indenfor de sidste 4 uger
1.6.7 Anden opmærksomhed ved behandling med nintedanib
Patienter som er bloddonorer skal udmeldes af donorkorpset når nintedanib startes. Visse tilstande kan betyde, at nintedanib skal pauseres eller seponeres. Det kan dreje sig om:
- Perforeret mavesæk eller tarm
- Større sår (nintedanib kan potentielt hæmme sårhelingen)
1.6.8 Anden antifibrotisk behandling
Flere mindre studier har vist tilsvarende antifibrotisk effekt af pirfenidon hos patienter med PF-ILS, og pirfenidonbehandling kan derfor overvejes såfremt nintedanib ikke tolereres.
1.6.9. Patientuddannelse
Brug tid på at instruere pt. grundigt ved start på nintedanib. Gennemgå bivirkninger, forventet varighed samt giv information om f.eks. loperamid og rehydrering.
1.7. KONTROL
Ved opstart af behandling med nintedanib
Jf. mulige bivirkninger bør der foretages blodprøvekontrol indeholdende hæmatologi, leverenzymer og væsketal initialt hver måned de første 6 måneder. Endvidere bør der aftales kontakt med patient pr. telefon ved sygeplejerske efter senest 1 måned i.f.t. evt. bivirkningshåndtering, dosisjustering eller pausering. Herefter opfølgning som nedenfor.
Igangværende behandling med nintedanib
Da PF-ILS er kroniske sygdomme vil der være behov for langvarig opfølgning. Sygdommene præsenterer sig dog med varierende progressionsgrad, hvorfor der anbefales klinisk opfølgning jf. ”disease behaviour classification”, som er skitseret i DLS retningslinjen for ”Interstitielle lungesygdomme” (se venligst denne). Opfølgning bør indeholde blodprøver, spirometri og diffusionskapacitet, evt. 6 min. gangtest og HRCT thorax ved mistanke på forværring eller som led i differentialdiagnostik. Blodprøver bør kontrollers hver 3. måned, og på baggrund af sygdomssværhedsgrad og sygdomsaktivitet anbefales klinisk kontrol ca. hver 3- 6. måned.
1.8. PROGNOSE
De patogenetiske mekanismer, det kliniske og radiologiske sygdomsbillede samt prognose er sammenlignelige mellem PF-ILS og IPF, og PF-ILS er således forbundet med nedsat funktionsniveau, forværret livskvalitet og tidlig død trods immunmodulerende og antifibrotisk behandling. Patienternes prognose er afhængig af omfanget af fibrosen, hvorvidt usual interstitial pneumonia (UIP) mønster er til stede, hvor hurtigt lungefunktion falder og frekvensen af akutte eksacerbationer. Gennemsnitsoverlevelsen fra diagnosetidpunkt afhænger af underliggende ILS-subtype, men ved manifest UIP estimeres en 50% overlevelse at være 2-10 år fra diagnosetidspunkt.
For selekterede patienter bør man på et tidligst tidspunkt overveje mulighed for lungetransplantation (se venligst DLS retningslinjen for ”Lungetransplantation”), og ved persisterende sygdomsprogression og manglende effekt af antifibrotisk behandling anbefales ligeledes henvisning til palliative teams.
1.9. REFERENCER
- Dansk Lungemedicinsk Selskab. Retningslinjer – Interstitielle lungesygdomme (ILS). 2020; Tilgængelig fra: https://lungemedicin.dk/interstitielle-lungesygdomme-ils/
- Dansk Lungemedicinsk Selskab. Retningslinjer – Idiopatisk pulmonal fibrose (IPF). 2020; Tilgængelig fra: https://lungemedicin.dk/idiopatisk-pulmonal-fibrose-ipf/
- Medicinrådets protokol for vurdering vedr. nintedanib til PF-ILS-vers. 1.0 (medicinraadet.dk)
- Flaherty KR, Wells AU, Cottin V, Devaraj A, Walsh SLF, Inoue Y, et al. Nintedanib in Progressive Fibrosing Interstitial Lung Diseases. N Engl J Med. 2019;381(18):1718–27.
- Distler O, Highland KB, Gahlemann M, Azuma A, Fischer A, Mayes MD, et al. Nintedanib for Systemic Sclerosis–Associated Interstitial Lung Disease. N Engl J Med. 2019;380(26):2518–28.
- Wijsenbeek M, Cottin V. Spectrum of Fibrotic Lung Diseases. Drazen JM, red. N Engl J Med. 2020;383(10):958–68.
- Raghu G, Remy-Jardin M, Myers JL, Richeldi L, Ryerson CJ, Lederer DJ, et al. Diagnosis of Idiopathic Pulmonary Fibrosis. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med. 2018;198(5):e44–68.
- Wells AU, Brown KK, Flaherty KR, Kolb M, Thannickal VJ. What’s in a name? That which we call IPF, by any other name would act the same. Eur Respir J. 2018;51(5):1800692.
- Cottin V, Wollin L, Fischer A, Quaresma M, Stowasser S, Harari S. Fibrosing interstitial lung diseases: knowns and unknowns. Eur Respir Rev. 2019;28(151):180100.
- George PM, Spagnolo P, Kreuter M, Altinisik G, Bonifazi M, Martinez FJ, et al. Progressive fibrosing interstitial lung disease: clinical uncertainties, consensus recommendations, and research priorities. Lancet Respir Med. 2020;8(9):925–34.
- Brown KK, Martinez FJ, Walsh SLF, Thannickal VJ, Prasse A, Schlenker-Herceg R, et al. The natural history of progressive fibrosing interstitial lung diseases. Eur Respir J. 2020;55(6):2000085.
- Wollin L, Distler JHW, Redente EF, Riches DWH, Stowasser S, Schlenker-Herceg R, et al. Potential of nintedanib in treatment of progressive fibrosing interstitial lung diseases. Eur Respir J. 2019;54(3):1900161.
- Dansk Lungemedicinsk Selskab. Retningslinjer – Lungetransplantation. 2023; https://lungemedicin.dk/lungetransplantation/