1.1. DEFINITION
Sarkoidose er en systemisk granulomatøs sygdom karakteriseret ved dannelse af epithelioidcellegranulomer med flerkernede kæmpeceller uden central nekrose i de involverede organer, hvor anden årsag til granulomatøs sygdom er udelukket. Stort set alle organer kan være involveret, men lunger og/eller thorakale lymfeknuder er involverede hos > 90%.
1.2. ÆTIOLOGI
Årsagen til sygdommen er ukendt. Meget tyder på at den granulomatøse inflammation kan initieres af visse infektiøse organismer såsom svampe og mykobakterier eller andre miljøfaktorer. Udviklingen af sarkoidose kræver, at man er genetisk disponeret til at reagere med et specifikt immunologisk mønster.
1.3. FOREKOMST
I et nyere dansk registerstudie fandt man stigende incidens af sarkoidose fra 2001 til 2015, hvor incidensen i 2015 var 14,8 per 100.000 personår, sv.t. ca. 640 nye tilfælde om året.
Der sås en lille overvægt af mænd (56%) og gennemsnitsalder ved diagnose var 46 år.
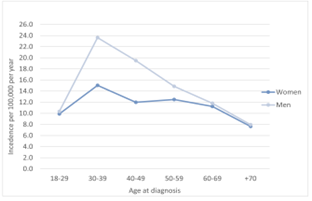
Figur 1. Incidens af sarkoidose i Danmark i relation til alder og køn fra 2001 til 2015.
1.4. PATOGENESE
Patogenesen er ikke fuldt afklaret. Udviklingen af sarkoidose kræver som anført både et antigen og en genetisk disposition. Antigenet er ukendt og den genetiske komponent viser sig ved at sygdommen optræder i familier og forekommer hyppigere hos monozygote end hos dizygote tvillinger. Sarkoidose er associeret til HLA genotyper. Visse genotyper kan relateres til specifikke kliniske fænotyper af sarkoidose (Löfgrens syndrom ved HLA-DRB1*03) og andre til risikoen for at udvikle sygdommen.
Den granulomatøse inflammation reguleres ved et komplekst samspil af immunkompetente celler (T-lymfocytter, makrofager, B-lymfocytter m.fl.), som interagerer gennem frigørelse af cytokiner og kemokiner. Det viser sig i lungerne initialt som en lymfocytær alveolitis. Gennem proliferation af makrofager, transformation til epithelioidceller og fusion til flerkernede kæmpeceller dannes de sarkoide granulomer.
Granulomet er en metabolisk aktiv struktur, som danner angiotensin konverterende enzym (ACE), vitamin D3 og en række cytokiner. Blandt disse spiller specielt interleukin-2 (IL2) receptor og TNF-α en afgørende rolle for dannelse af granulomer.

Figur 2: Velformede epiteloidcellegranulomer i lymfeknudebiopsi.
I det videre forløb kan sygdommen tage to veje: Regression af granulomerne ved cellulær apoptose eller dannelse af kronisk inflammation med risiko for fibrose og permanent organskade.
1.5. KLINISK PRÆSENTATION
Sarkoidose er en systemsygdom, som kan angribe alle organer, hvilket ofte frembyder differentialdiagnostiske vanskeligheder overfor en række andre sygdomme. Blandt patienterne er 30-50% asymptomatiske på diagnosetidspunktet.
Sygdomsdebut:
Sarkoidose kan debutere akut, subakut eller kronisk. Det akutte forløb med forstørrede hilære lymfeknuder, feber samt erythema nodosum og/eller artritis/periartritis i de store led (ankler) ses hyppigst hos yngre patienter (Löfgrens syndrom). Ved subakut debut kommer sygdommen snigende, mens der ved den kroniske form er indtrådt organskade på diagnosetidspunktet.
Pulmonal sarkoidose:
I flere end 90% af tilfældene er lunger eller thorakale lymfeknuder involverede. Respiratoriske symptomer i form af tør hoste og tiltagende funktionsdyspnø optræder hos ~50% af patienterne. Nogle patienter har uspecifikke brystsmerter og hæmoptyse ses sjældent. Lungeparenkymet er oftest ramt, men også de større luftveje (larynx, trachea og bronkierne) kan afficeres og medføre luftvejsobstruktion.
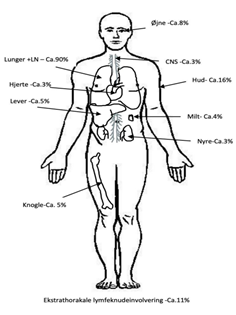
Figur 3: Organaffektion ved sarkoidose
Ekstrapulmonal sarkoidose:
Patienterne kan have affektion af ét eller flere organsystemer uden at have klinisk betydende lungeaffektion.Hos nogle ses kun klinisk affektion af et enkelt ekstrapulmonalt organ som fx hjerte eller nyrer.
Almensymptomer:
Feber, generel utilpashed og vægttab ses hos 10-15% af patienterne.
Artritis/periartritis:
Ses i det initiale akutte forløb og rammer ofte større led ledsaget af hævelse og ømhed. Artralgier ses hos ca. 10-15%.
Hud:
Sarkoidose er den hyppigste årsag til erytema nodosum, som skyldes vaskulitis og ses ved Löfgrens syndrom. Hudsarkoidose viser sig som faste, eleverede, blå- eller brunrøde hudelementer som kan sidde overalt på kroppen, ofte i ansigtet og på ekstremiteterne.
Øjne:
Alle dele af øjet kan afficeres, men væsentligst er anterior uveitis (iridocyclitis), der ofte er debutsymptom, og som ubehandlet kan medføre synstab.
Perifere lymfeknuder:
Ekstrathorakal lymfeknudeinvolvering ses hos omkring 10% af patienterne.
Lever:
Hos 50% af patienterne findes der granulomer i en leverbiopsi, men kun 6% har klinisk leveraffektion i form af sarkoid hepatitis med abnorme leverprøver.
Nyrer:
Hyppigst ses nefrocalcinose/urolithiasis pga. hypercalcæmi/hypercalcuri. Enkelte patienter udvikler interstitiel granulomatøs nefritis med fibrose og nyreinsufficiens. Hypercalcæmi ses hos 5-10%.
Hjerte:
Ved autopsi findes granulomer i hjertet hos 30% af patienter med sarkoidose. Dog har kun 5% klinisk hjertesygdom med bl.a. atrioventrikulært blok eller arytmier og evt. hjertesvigt.
Perifere nervesystem:
Mononeuritis ses hos ganske få % af patienterne, ofte som perifer facialisparese. Småfiber-neuropati ses hos enkelte og kan give perifere smerter og påvirkning af autonome funktioner.
Centralnervesystem:
CNS er kun sjældent involveret. Alle dele af meninges og hjernen kan være afficeret.
Fatigue:
Er rapporteret hos op til 80% af patienterne. Fatigue korrelerer dårligt med den øvrige sygdomsaktivitet og har ofte negativ indflydelse på livskvaliteten. Ætiologien er formentlig multifaktoriel, og subklinisk sygdomsaktivitet, medikamentelle bivirkninger, søvnforstyrrelser, angst og depression kan influere.
1.6. PARAKLINISKE FUND
Den objektive undersøgelse omfatter stetoskopi af hjerte og lunger samt undersøgelse af øjne, led, hud og perifere lymfeknuder. Udredningen omfatter røntgen af thorax, evt. (HR)CT skanning af thorax, udvidet lungefunktionsundersøgelse (LFU), EKG (evt. ekkokardiografi, Holter monitorering, MR-scanning eller hjerte-PET scanning ved mistanke om kardial sarkoidose). Fuld hæmatologisk status, biokemiske leverprøver, immunglobuliner, angiotensin konverterende enzym (s-ACE), kreatinin og ioniseret calcium, samt evt. IL-2 receptor, urinstix og døgnurin-calcium.
Røntgen (rtg.) af thorax:
Radiologisk kan pulmonal sarkoidose inddeles i 5 stadier.
| Stadie | Fund | % på diagnosetidspunkt | %Regression indenfor 5 år |
| Stadium 0 | Normalt røntgen af thorax. | 5-15 | |
| Stadium I | Bilateral forstørrelse af lymfeknuder i lungehilus uden lungeinfiltrater.
|
25-65 | 60-90 |
| Stadium II | Forstørrede lymfeknuder i lungehili/mediastinum med lungeinfiltrater. | 20-40 | 40-70 |
| Stadium III | Lungeinfiltrater uden hilusadenitis og uden tegn til fibrose.
|
10-15 | 10-20 |
| Stadium IV | Lungeinfiltrater med fibrose og skrumpning.
|
5 | 0 |
Tabel 1: Radiologisk stadieinddeling ved sarkoidose

Figur 4: Røntgen af thorax med sarkoidose i forskellige stadier. A) stadium I, B) stadium II, C) stadium III og D) Stadium IV.
(HR) CT af thorax kan vise forstørrede hilære og mediastinale lymfeknuder evt. med forkalkninger samt veldefinerede noduli med perilymfatisk distribution samt fibrose typisk med midt- og overzone involvering. CT kan undlades hos patienter med Løfgrens syndrom.
Lungefunktion:
Oftest er der sammenhæng mellem det radiologiske stadium og lungefunktionen, men hos nogle patienter findes dårlig korrelation mellem radiologi og lungefunktion. DLCO er den mest følsomme parameter til at vurdere påvirkning af lungefunktionen og er vigtig at have på diagnosetidspunktet. Der kan forekomme normale ventilationsparametre men påvirket diffusion. Ofte ses en blanding af obstruktivt og restriktivt mønster, og hos 30% af patienterne findes bronkial hyperreaktivitet ved provokationstest.
Pulmonal hypertension (PH):
Forekommer hyppigst hos patienter med svær fibrotisk sarkoidose (stadium IV), men kan ses i alle stadier som følge af varierende mekanismer (vaskulær sygdom, hjertesvigt og kompression fra lymfeknuder). PH forringer overlevelse og funktionsniveau. Ekkokardiografi bruges som screening, men diagnosen stilles ved højresidig hjertekaterisation.
Biokemiske fund:
De akutte fasereaktanter inklusiv CRP kan være forhøjede ved akut debuterende sygdom men er herefter oftest normale. Mange granulomer i knoglemarven kan medføre anæmi, leukopeni og trombocytopeni.
Leukocytdifferentialtælling kan være abnorm med bla. lymfopeni og eosinofili. Mange granulomer i leveren kan give påvirkede leverprøver med kolestatisk mønster. Pga. en overproduktion af vitamin D3 i granulomerne ses hypercalcæmi hos ~5-10% af patienterne. Både hypercalcæmi og granulomatøs nefritis kan medføre nedsat nyrefunktion og forhøjet P-kreatinin. Mange patienter har let forhøjede immunglobuliner, først og fremmest IgG og IgA.
S-ACE er ofte forhøjet på diagnosetidspunktet, men er ikke velegnet som diagnostisk værktøj, da specificiteten er lav. Ved akut debuterende sarkoidose er S-ACE ofte normal og stiger først nogle uger senere når granulomdannelsen er kommet i gang. Serum IL2-receptor er ofte forhøjet ved sygdommens debut som udtryk for den øgede T-lymfocyt aktivitet.
1.7. DIAGNOSEN
Baseres på kliniske og parakliniske fund forenelige med sarkoidose samt påvisningen af ikke-
nekrotiserende epithelioidcellegranulomer i et eller flere organer samt udelukkelse af andre årsager til granulomdannelse.
Differentialdiagnostisk overvejes: Infektioner (mykobakterier, svampe), cancerassocierede granulomer (lungecancer, malignt lymfom), allergisk alveolitis, granulomatose med polyangiitis (Wegener), mb. Crohn, pneumokonioser, immundefekt og lægemiddel-induceret reaktion (interferon α and β, intravesikal BCG, TNFα inhibitorer, immun-checkpoints inhibitorer).
Biopsi bør tages fra det nemmest tilgængelige organ, fx fra et hudelement eller fra en perifer lymfeknude. Det er vigtigt at sende materiale til undersøgelse for mykobakterier.
Diagnosen stilles ofte ved bronkoskopi med biopsi fra mediastinale lymfeknuder ved transbronkial finnålsaspiration vejledt af endobronkial ultralyd (EBUS-FNA) eller øsofageal ultralyd (EUS). Metoden har en høj træfsikkerhed og sensitivitet. Der suppleres med bronkoalveolær lavage (BAL) og bronkiale mukosabiopsier. Lymfocytose i BAL (15 – 25%) og CD4+/CD8+ ratio >3,5 ses typisk ved sarkoidose.
Hvis lungeparenkymforandringer er det dominerende kan transbronkial tang (fTBB)- eller cryobiopsi (TBCB) benyttes.
Biopsi kan undlades under tæt opfølgning ved:
- Löfgrens syndrom
- Heerfordts syndrom (spytkirtelhævelse, feber, uveitis og facialisparese)
- Asymptomatisk stadium 1
- En mindre gruppe af patienter med typisk klinisk præsentation og billeddiagnostik, der over tid er stabil eller regredierende efter drøftelse af invasive undersøgelser med patienten, overvejelse/ udelukkelse af differentialdiagnoser, samt evt. konsensus på multidisciplinær team konference. Det er en forudsætning at disse patienter indgår i kontrolforløb
1.8. VURDERING AF SYGDOMSAKTIVITET
Sygdomsaktiviteten vurderes bedst ved at sammenholde patientens symptomer med lungefunktionsundersøgelse og billeddiagnostiske undersøgelser.
Tiltagende dyspnø, hoste og træthed, progredierende infiltrater på røntgen af thorax, faldende lungefunktion (FVC, DLCO og hos ca. 50% af patienter FEV1) eller andre organspecifikke symptomer viser at sygdommen er aktiv. Biokemisk tyder forhøjede P-IgG/P-IgA, forhøjede leverprøver, hypercalcæmi, forhøjet P-kreatinin m.m. ligeledes på aktivitet.
S-ACE er en makrofagmarkør, der afspejler den aktive granulommasse og s-IL2-receptor afspejler lymfocytaktiviteten. Begge har en begrænset værdi ved monitorering af sarkoidose aktivitet, men kan have en plads hos enkelte patienter.
Der findes ikke et validt HRCT scoringssystem til vurdering af sværhedsgraden af sarkoidose, men fund af noduli, matglastegning og konsolidering korrelerer til histologisk aktiv granulomatøs inflammation, og kan anvendes til at understøtte vurderingen af sygdomsaktivitet.
Hos patienter med dominerende fibrotisk sarkoidose kan det være vanskeligt at vurdere aktiviteten, særlig under behandling. Her kan suppleres med F18-fluordesoxyglukose- positronemissionstomografi (FDG-PET), idet aktive granulomer har øget FDG optagelse. Ved CNS- og kardial sarkoidose anvendes MR-skanning med kontrastforstærkning til at påvise aktive granulomer.
Alle patienter bør omhyggeligt screenes for extrapulmonal manifestation og tilbydes henvisning til relevant speciale ved mistanke herom. En del sarkoidose patienter har derefter behov for dobbeltforløb og tværfaglig tilgang til behandlingsplan.
1.9. BEHANDLING
Generelt bør behandling initieres for at forhindre organskade, lindre symptomer og bedre livskvalitet. Der findes ingen specifik behandling for sarkoidose og behandlingen med immunsuppression kan medføre uønskede eller potentielt farlige bivirkninger. Derfor skal behandlingsindikationen overvejes nøje og diskuteres med patienten. Størstedelen af patienterne, ca. 80 % behøver ingen behandling og kommer sig spontant indenfor få år.
1. Linie behandling – Prednisolon:
Steroid har en bred antiinflammatorisk virkning og dæmper granulomdannelsen. De fleste sarkoidosecentre bruger langtidsbehandling med prednisolon til kronisk aktiv sarkoidose. Startdosis 20-40 mg prednisolon dagligt i 4-6 uger. Højere dosis kan være nødvendig ved nogle tilfælde af hjerte-, nyre-, CNS- og øjensarkoidose. Herefter evalueres behandlingseffekten og ved tilfredsstillende respons startes aftrapning, hvor dosis reduceres over 4-6 måneder til en vedligeholdelse dosis på 5-10 mg/dag. Varighed i alt 6-18 mdr. Ved langvarig prednisolon behandling bør vedligeholdelsesdosis højst være 10 mg/dag.
Kalk og D-vitamin: 5-10 % af sarkoidose patienterne har hyperkalkæmi.
Ved risiko for osteoporose (prednisolon behandling > 3 måneder eller postmenopausal) kan der, ved osteopeni/ osteoporose gives kalk og D-vitamin tilskud til patienter uden tegn til hyperkalkæmi eller nyresten, hvis der er normal PTH og normal eller lav 25-hydroxy-vitamin D og 1,25-dihydroxy-vitamin D. Ved abnorm calciummetabolisme kun bisfosfonat. Hvis DEXA er normal gives blot D-vitamin.
Forbedring af livskvalitet:
Livskvaliteten kan være påvirket af hoste, funktionsdyspnø, træthed, muskel/ledsmerter, hudforandringer m.m. som ikke afspejler organskade. Behandling med lavere dosis steroid (10-15 mg med nedtrapning) kan overvejes individuelt afhængigt af den enkelte patients ønsker og værdier.
Inhalationssteroid:
Har ingen dokumenteret effekt på sygdomsforløbet og kan ikke erstatte systemisk steroid. Bronkial hyperreaktivitet ses hos 30% af patienterne og kan vise sig ved irritationshoste og astma bronkiale med svingninger i lungefunktionen og positiv reversibilitetstest efter inhalation af β2-agonist. Disse patienter kan behandles med inhalationssteroid i høj dosis evt. i kombination med langtidsvirkende β2-agonist. Det er vigtigt at behandling med ICS ikke forsinker systemisk behandling ved progressivt fald i lungefunktionen.
2. Linie behandling – Methotrexat:
Indikationer:
– Steroid refraktær sygdom
– Uacceptable steroid-inducerede bivirkninger
– Steroidbesparende agens ved vedvarende behov for prednisolon >10 mg
– 1. linje behandling i kombination med steroid ved nogle tilfælde af øjen- neuro- og kardiel sarkoidose.
Methotrexat har steroidbesparende effekt ved sarkoidose. Maksimal virkning ses efter 6 måneders behandling. Startdosis er 5 mg/uge som efter 1 uge kan øges til 10 mg og en uge efter til 15 mg/uge. Behandlingen suppleres med folinsyre 5-10 mg/uge på en anden ugedag end methotrexat. Før og under behandlingen måles: Hb, Leucocytter og evt. differentialtælling, thrombocytter, væsketal, levertal og nyretal. Blodprøver kontrolleres tæt ved behandlingsstart og med længere intervaller senere (f.eks. ugentligt i den 1. måned og herefter 1 gang hver 2.-3. måned).
Ved gastrointestinale bivirkninger og stomatitis kan dosis forsøges splittet op i to doser (tages inden for 12 timer) eller skift til SC/IM indgift.
Pause MTX: Knoglemarvshæmning eller betydende leverpåvirkning (Stigning i ALAT med en faktor > x 2-3). Kan forsøges genoptaget i halv dosis (7,5 mg om ugen).
Seponering: Svær infektion, nyrefunktionspåvirkning samt ved vedvarende lever- eller knoglemarvspåvirkning.
Behandlingsvigt/ bivirkninger/ pneumonitis: Overvej skift til:
Azathioprin alternativt mycophenolat mofetil, leflunomid eller hydroxychloroquin.
Hydroxychloroquin: Anvendes hovedsageligt som 2. linje behandling af hud- og nyresarkoidose. Dosis er 200-400 mg/ dag. Pga. risikoen for retinopati skal der udføres øjenundersøgelse før behandling og herefter hver 12. måned.
3. Linie behandling – Anti-TNF-α behandling:
Biologiske lægemidler er introduceret i behandlingen af sarkoidose som tillæg til 2. linje behandling med eller uden prednisolon. De bør forbeholdes patienter med refraktær sygdom overfor konventionel behandling. Der findes flere forskellige TNF-alfa inhibitorer, men ikke alle har effekt ved sarkoidose. Det mest gennemprøvede er infliximab, et humaniseret monoklonalt antistof, der inaktiverer TNF-α. Dosis er 3-5 mg/kg legemsvægt intravenøst uge 0, 2 og 6 og herefter hver 4-8. uge afhængig af terapeutisk effekt. Adalimumab gives som subkutan injektion 40 hver anden uge. Der bør samtidig gives methotrexat mindst 10 mg/uge, bl.a. for at hindre, at patienten danner antistoffer mod infliximab/adalimumab.
Behandling med TNF-α blokker er en specialopgave. Der er øget risiko for infektioner, herunder mykobakterier. Før behandling tages T-spot/ quantiferon, HIV-test og hepatitis screening.
Ved progredierende fibrotisk sarkoidose kan antifibrotisk behandling med nintedanib anvendes.
Lungetransplantation – Skal overvejes ved svær fibrotisk pulmonal sarkoidose, især hvor der samtidig er mistanke om PH. Se særskilt retningslinje om Lungetransplantation.
Pulmonal Hypertension:
Der er ikke evidens for specifik behandling af pulmonal hypertension ved sarkoidose. Såfremt behandling overvejes, bør patienten vurderes i specialenhed med kendskab til PH. Eksperimentel behandling med en vasodilator kan hos enkelte patienter være en mulighed.
Behandling af Fatigue:
Vurder graden af fatigue med Fatigue Assesment Scale (FAS).
Hvis der er behandlingsindikation for sarkoidose (organinvolvering /dysfunktion) behandles denne.
Andre årsager til fatigue vurderes og behandles: Søvnapnø, angst, depression, anæmi, myksødem, D-vitamin mangel, hyperkalcæmi, diabetes.
Fysisk træning anbefales til alle.
Ved fortsat markant fatigue overvejes neurostimulant (methylphenidat), lavdosis prednisolon og/eller methotrexat.
1.10. GRAVIDITET
Let til moderat sygdom er ingen kontraindikation mod graviditet. Der bør holdes pause med im-munmodulerende behandling før konception og under amning af hensyn til fosteret/barnet. Ved behandlingsbehov under graviditet kan prednisolon og evt. azathioprin anvendes. Der er ingen risiko for at overføre sygdommen til barnet og ingen øget risiko for misdannelser. Hos de fleste patienter medfører graviditet en bedring i symptomerne og steroiddosis kan ofte reduceres. Der er i et studie påvist øget risiko for eklampsi, præeklampsi, dyb vene trombose, lungeemboli, sectio og for tidlig fødsel hos kvinder med sarkoidose. Hos nogle ses en opblussen af sygdommen 3-6 måneder efter fødslen.
1.11. FORLØB OG PROGNOSE
Prognosen for sarkoidose er generelt god. Op til 80% remitterer spontant inden for 2-5 år og får aldrig behov for behandling. Mortaliteten af sarkoidose er ca. 5%, dette primært som følge af komplicerende lungefibrose, hjerte-, neurosarkoidose eller komplikationer til langvarig immunsuppression.
Ca. 5% af sarkoidosepatienter der remitterer får let/moderat permanent organskade. Hos ~15-20% forløber sygdommen kronisk aktivt med progredierende organskade.
| God prognose ved sarkoidose |
Mindre god prognose ved sarkoidose
|
| Alder < 40år | Alder >40 år
|
| Akut/subakut debut | Snigende debut
|
| Löfgrens syndrom | Ekstrapulmonal sygdom
|
| Radiologisk stadium I, (II) | Radiologisk stadium (II), III, IV
|
|
Regression af lungeinfiltrater indenfor 1-3 år |
Lungeinfiltrater stationære eller progredierende indenfor 2-3 år.
|
| Udvikling af PH
|
1.12. KONTROL
Der er ingen evidens for at tæt kontrol ændrer på prognosen for patienter med sarkoidose. Der er dog bred enighed om, at patienter bør følges minimum 2 år efter remission. Efter at diagnosen er stillet, kontrolleres patienten ambulant afhængigt af organinvolvering og behov for hurtig opstart af behandling (se behandlingsafsnit).
Ved patienter uden behov for hurtig iværksættelse af behandling vurderes patienten efter ca. 3-6 måneder med henblik på aktivitet.
Ved remission (aftagende forandringer på rtg. thorax), normale blodprøver (S-ACE, kreatinin, calcium og evt. IL2-receptor) og normal udvidet lungefunktion kan pt. følges mindre hyppigt,
Ved fortsat paraklinisk tegn på aktivitet, men normal lungefunktion inkl. diffusion kan pt. følges med intervaller på ca. 6-12 mdr.
Ved sygdomsaktivitet og fald i lungefunktion og/eller diffusion bør pt. følges tæt f.eks. hver 3.-6. måned. Patienter der kræver behandling bør ligeledes følges min. hver 3.-6. måned.Ved stabil ikke-behandlingskrævende sygdom bør patienterne følges med rtg. thorax og lungefunktion inkl. diffusion min. hver 6-12. måned. Supplerende blodprøver vurderes undervejs.
1.13. REFERENCER
Gade MS, Hilberg O, Ibsen R, et al. Sarcoidosis: A nationwide registry-based study of incidence, prevalence and diagnostic work-up. Respiratory Medicine 187 (2021) 106548
Crouser ED, Maier LA, Wilson KC, et al. Diagnosis and Detection of Sarcoidosis. An Official American Thoracic Society Clinical Practice Guideline. Am J Respir Crit Care Med. 2020 Apr 15;201(8):e26-e51
Thillai M, Atkins CP, Crawshaw A, Hart SP, et al. BTS Clinical Statement on pulmonary sarcoidosis. Thorax. 2021 Jan;76(1):4-20. doi: 10.1136/thoraxjnl-2019-214348. Epub 2020 Dec 2. Erratum in: Thorax. 2021 Jul;76(7):e4. PMID: 33268456.
Baughman RP, Valeyre D, Korsten P, et al. ERS clinical practice guidelines on treatment of sarcoidosis. European Respiratory Journal Jan 2021, 2004079; DOI: 10.1183/13993003.04079-2020
ERS Monograph on Sarcoidosis (Editors: Francesco Bonella, Daniel A. Culver et al. March 2022
Zhou Y, Lower EE. Balancing Altered Calcium Metabolism with Bone Health in Sarcoidosis
Seminars in respiratory and critical care medicine, 2020-10, Vol.41 (5), p.618-625
Statement on sarcoidosis. Joint Statement of the ATS/ERS/WASOG. Am J Respir Crit Care Med 1999;160:736-55.
Celeda LJ, Hawkins C, Drake WP. The Etiologic role of infectious antigens in sarcoidosis pathogenesis. Clin Chest Med 2015;36:561–568.
Baughman RP, Culver DA, Judson MA. A concise review of pulmonary sarcoidosis. Am J Respir Crit Care Med Vol 183. pp 573–581, 2011.
Von Bartheld MB, Dekkers OM, Szlubowski A et al. Endosonography vs Conventional Bronchoscopy for the Diagnosis of Sarcoidosis The GRANULOMA Randomized Clinical Trial. JAMA 2013;309(23):2457-2464.
Keijsers RG, Verzijlbergen EJ, van den Bosch JM et al. 18F-FDG PET as a predictor of pulmonary function in sarcoidosis. Sarcoidosis Vasc Diffuse Lung Dis 2011;28(2):123-9.
Cremers JP, Drent M, Bast A et al. Multinational evidence-based World Association of Sarcoidosis and Other Granulomatous Disorders recommendations for the use of methotrexate in sarcoidosis: integrating systematic literature research and expert opinion of sarcoidologists worldwide. Curr Opin Pulm Med. 2013 Sep;19(5):545-61.
Pilar Brito-Zerón, Roberto Pérez-Alvarez, Lucio Pallarés et al. Sarcoidosis: an update on current pharmacotherapy options and future directions. Expert Opinion on Pharmacotherapy. Published online: 24 Nov 2016.
Vicky Hadid, Valerie Patenaude, Lisa Oddy L et al. Sarcoidosis and pregnancy: obstetrical and neonatal outcomes in a population-based cohort of 7 million births. J Perinat Med 2015;43(2): 201–207.
Milman N, Burton CM, Carlsen J et al. Pulmonal hypertension in end-stage pulmonary sarcoidosis: therapeutic effect of sildenafil? Journal of Heart and Lung Transplantation 2008;27:329-34.
Baughman RP, Engel PJ, Nathan S. Pumonary hypertension in Sarcoidosis. Clin Chest Med 2015;36:703–714.