Denne retningslinje beskriver udredning og vurdering af voksne patienter med mulig svær astma med henblik på at skelne mellem egentlig svær astma (eng: Severe asthma), og astma hvor manglende kontrol skyldes andre faktorer (eng: Difficult-to-treat-asthma) (Figur 1). Retningslinjen beskriver desuden anbefalinger vedrørende den generelle behandling af svær astma. Behandling med biologiske lægemidler inklusiv hjemme administration findes i særskilt retningslinje.
Bilag:
1. INTRODUKTION
Astma er en kompleks, heterogen sygdom med et forskelligartet behandlingsrespons. Størstedelen af patienter med astma har mild–moderat grad af sygdom, hvor god sygdomskontrol kan opnås med lav-moderate doser af astma medicin. En lille gruppe har et vedvarende behov for højdosis astma behandling (svarende til GINA step 5, se Figur 3) i forsøget på at
opnå god astma kontrol1. Der er mange årsager til dårlig astma kontrol – og mindre end halvdelen af patienter med ukontrolleret astma trods maksimal standard astma behandling kan
kategoriseres som havende egentlig svær astma, når eksterne årsager til nedsat astma kontrol er adresserede2–5. Derfor bør patienter med vedvarende behov for højdosis astma behandling (mulig svær astma) gennemgå en systematisk udredning i specialist regi for at sikre en korrekt diagnose af svær astma1,6–8.
Prævalensen af svær astma er estimeret til kun at udgøre 4-8% af alle patienter med astma2,9–11. Disse patienter er præget af stor morbiditet grundet hyppige eksacerbationer, nedsat livskvalitet og risiko for alvorlige bivirkninger til behandlingen12–14. Gennem de senere år er nye biologiske behandlingsmuligheder til svær astma blevet tilgængelige i Danmark. Disse behandlinger blokerer specifikke signalveje i immunsystemet, hvorfor de kun er effektive i særlige undergrupper med svær astma; hvilket understreger vigtigheden af en systematisk udredning og detaljeret fænotypning for at identificere de patienter, som har størst sandsynlighed for at profitere af disse biologiske lægemidler.
2. DEFINITION
ERS/ATS definerer svær astma, som astma, der kræver behandling med højdosis inhalationssteroid samt en anden forebyggende behandling (”2nd controller”), eller fast behandling med peroralt steroid for at opnå astma symptom kontrol, eller som forbliver ukontrolleret trods denne behandling (Se tabel 1 og 2)7,8. Astma diagnosen skal bekræftes objektivt og mulige andre årsager til manglende astma-kontrol skal så vidt muligt være adresserede (Figur 1). Dermed differentieres patienter med svær astma fra dem, hvor nedsat astma kontrol er forårsaget af eksterne faktorer, såsom dårlig adhærens, forkert inhalationsteknik eller ubehandlede komorbiditeter/triggers (difficult-to-treat astma). Dette inkluderer en reevaluering i specialist regi typisk efter 3-6 måneder før diagnosen svær astma endeligt kan stilles6,7 (Figur 1). Nogle patienter i højdosis astma behandling er reelt set overbehandlede, hvorfor forsøg på nedtrapning af ICS hos patienter med god sygdomskontrol er vigtig.
Ukontrolleret astma hos patienter med svær astma defineres som dårlig symptom kontrol, svære eller hyppige eksacerbationer eller lav lungefunktion (Tabel 1)
Tabel 1. Definition på svær astma*
Astma som kræver behandling i henhold til GINA guidelines trin 5 (højdosis ICS + LABA, LTRA, LAMA eller teofyllin gennem minimum et år, og/eller behandling med peroralt steroid ≥50% af tiden for at opretholde sygdomskontrol, eller som forbliver ukontrollerede trods denne behandling.
Ikke kontrolleret astma defineres som mindst én af følgende:
- Utilstrækkelig symptomkontrol: ACQ>1.5, ACT<20, ikke velkontrolleret jf. GINA
- Hyppige eksacerbationer med behov for peroralt steroid i min 3 dage (> 1 det sidste år)
- Alvorlige eksacerbationer: Hospitalsindlæggelse, behandling på intensiv afdeling, respiratorbehandling inden for det seneste år
- Nedsat lungefunktion (FEV1 1/FVC ratio <LLN
GINA: Global Initiative for Asthma. ICS: Inhalationssteroid. LABA: Langtidsvirkende beta-2-agonist, LTRA: Leukotrien antagonist. LAMA: Langtidsvirkende antikolinergikum.
ACQ: Asthma Control Questionnaire. ACT: Asthma Control Test. LLN: Lower limit of normal
* I.h.t. ERS/ATS guidelines on severe asthma7,8
Tabel 2. Definition af højdosis inhalationssteroid iht ERS/ATS guidelines (voksne) 7,8
| Tabel 2. Definition af højdosis inhalationssteroid iht ERS/ATS guidelines (voksne)7,8 | |
| Navn | Døgndosis (μg)* |
| Budesonid | ≥1600 (inh. pulver/inh. spray)** |
| Fluticason dipropionat | ≥1000 (inh. pulver/inh. spray) |
| Mometason furoate | ≥800 (inh. pulver) |
| Beclomethason | ≥1000 (inh. spray) ; ≥2000 (inh. pulver) |
| Ciclesonid | ≥320 (inh. spray) |
| Fluticason furoat | ≥184 (inh. pulver) |
| *angivet i ”measured dose”; **kombination budesonid-formeterol: 1280 μg (”delivered dose”) | |
Figur 1: Patienter med mulig svær astma differentieres gennem systematisk udredning i henholdsvis svær versus ”difficult-to-treat” astma
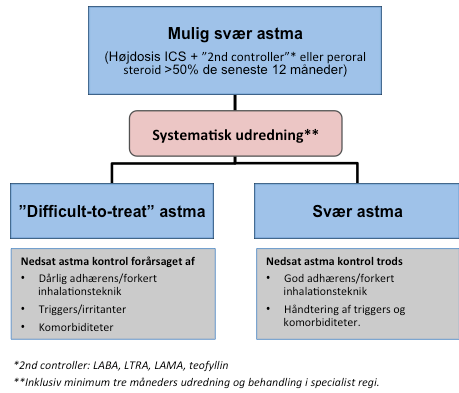
(Figur adapteret fra ”Nordic Severe Asthma Network Pocket Guide: Systematic assessment and management of possible severe asthma in adults”15)
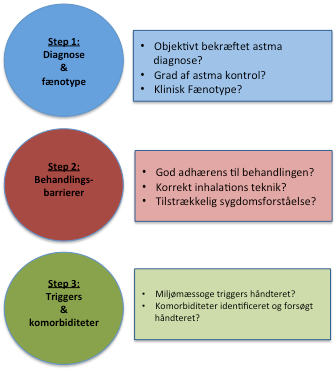
2. SYSTEMATISK UDREDNING AF MULIG SVÆR ASTMA
Ved mistanke om svær astma bør der foretages en systematisk udredning af patienten, med henblik på at bekræfte diagnosen og vurdere fænotypen, udelukke differentialdiagnoser, samt vurdere eventuelle behandlingsbarrierer, triggers og komorbiditeter (Figur 2).
Figur 2: Trinvis systematisk udredning af mulig svær astma
2.1. Trin 1. Diagnose og fænotype
2.1.1. Bekræft astma diagnosen
Diagnosen astma stilles på baggrund af en grundig anamnese vedrørende symptomer, samt påvisning af variabel luftvejsobstruktion (reversibilitet overfor beta-2-agonist, ICS eller systemisk steroid, peak flow variabilitet eller bronkial hyperreaktivitet). Se også DLS retningslinje for udredning og behandling af astma. Specielt hos patienter med mulig svær astma, som per definition har et nedsat respons på astma behandling, bør man være ekstra omhyggelig med at sikre, at astma diagnosen er korrekt.
Bronkiale provokations tests (mannitol, metakolin) har højere sensitivitet end reversibilitetstest, men kræver bevaret lungefunktion (mannitol: præbronkodilatorisk FEV1≥70%16; metakolin: præbronkodilatorisk FEV1≥60%17). Diagnosen kan dog være svær at bekræfte og ofte er det nødvendigt at udføre flere diagnostiske test4.
Nogle patienter har kronisk nedsat lungefunktion grundet remodellering af luftvejene, hvilket udelukker bronkial provokationstest og dermed kan diagnosen være nødsaget til at være symptombaseret i nogle enkelte tilfælde
Hos patienter i højdosis behandling, hvor de diagnostiske tests er negative, bør det altid overvejes at nedtrappe behandlingen med henblik på at kunne bekræfte diagnosen.
Ved tvivlstilfælde bør relevant udredning overvejes med henblik på at udelukke differentialdiagnoser (Tabel 3).
| Tabel 3. Differentialdiagnoser ved svær astma (voksne) |
| Dysfunktionel vejrtrækning/ kronisk hyperventilation*
Kronisk obstruktiv lungesygdom*/emfysem Bronkiektasier* Inducerbar laryngeal obstruktion (ILO)* Bronchiolitis obliterans Cystisk fibrose Hypersensitivitets pneumonitis (HP) Hypereosinofile lungesygdomme Eosinofil Granulomatøs Polyangitis[ (EGPA) Sarkoidose Allergisk Bronchopulmonal Aspergillosis (ABPA)* Tracheobronchomalaci Lungeemboli Mb. Cordis inkompensatus Endobronchial tumor/fremmedlegeme Pulmonal hypertension |
| *Kan også være komorbiditet til svær astma |
2.1.2. Astma kontrol
Graden af astmakontrol bør hos disse patienter vurderes systematisk som angivet i tabel 1 og med brug af validerede spørgeskemaer, så som ACQ eller ACT (Se bilag – Kan downloades til klinisk brug).
2.1.3. Fænotype
Astma opfattes i dag som en sygdom med flere undertyper, karakteriseret ved forskelle i klinisk præsentation og underliggende patogenetiske mekanismer. Der er aktuelt ikke en samlet international konsensus om klassifikationen af kliniske astma fænotyper, men der pågår en væsentlig forskningsaktivitet på området7. Der er dog til en vis grad konsensus om følgende kliniske fænotyper af svær astma:
Svær allergisk astma. Oftest tidlig debut. God sammenhæng mellem grad af eosinofil luftvejsinflammation og symptomgrad
Sent debuterende svær eosinofil astma (”Late-onset eosinophilic asthma”). Kendetegnet ved mange eksacerbationer og forhøjede blod eosinofile. Ofte non-allergisk. Disse patienter har oftest co-eksisterende nasal polypose, og NSAID/acetylcystein intolerans (aspirin-exacerbated respiratory disease (AERD) eller Samter´s triade).
Sent debuterende, non-eosinofil astma.
Graden og typen af luftvejsinflammation er vigtig at udrede hos patienter med svær astma, idet de biologiske behandlinger (se særskilt vejledning) på nuværende tidspunkt er til patienter med Type 2 (T2) astma.
T2 astma er domineret af eosinofil luftvejsinflammation, hvor non-T2 astma er karakteriseret ved neutrofil eller ingen inflammation18–21. T2 astma involverer aktivering af T-hjælper celle 2, innate lymfoide celler, eosinofile celler, mast celler og IgE producerende beta celler og er karakteriseret ved høje niveauer af T2 cytokiner, såsom IL-5, IL-4, IL-1321,22.
Guldstandarden til udredning af luftvejsinflammation ved astma er induceret sputum, som dog kun er klinisk tilgængelig på få centre i DK. I daglig klinisk praksis anvendes derfor blod eosinofile og FeNO til at beskrive graden af eosinofil luftvejsinflammation (se nedenfor). Luftvejsinflammation kan også beskrives via bronkoskopi og bronkial lavage.
I klinisk praksis bør følgende kliniske karakteristika beskrives:
Tidlig/sen-debut af astma symptomer
Tilstedeværelse af T2 inflammation?
- IgE medieret allergi: Positiv priktest/ forhøjet specifik IgE (> 0.35 kU/L) for inhalationspanel kombineret med symptomer ved relevant allergen eksposition?26
- Eosinofil luftvejsinflammation (nuværende/tidligere?)
- Blod eosinofile: Der er ikke konsensus om et specifikt cut-off for blod eosinofile, men en grænse på 0,30 x 109/ L indenfor de seneste 12 mdr. er vist at prædiktere effekt af anti-IL5 behandling af svær eosinofil astma 23,24.
- FeNO: >50 ppb medfører en høj positiv prædiktiv værdi for aktuel eosinofil luftvejsinflammation, som derimod er mindre sandsynlig ved en værdi Sputum eosinofile ≥3% (kun tilgængeligt på få centre)Hos patienter uden tegn til T2 inflammation bør blod eosinofile og FeNO måles flere gange, og hvis muligt udføres induceret sputum/bronkoskopi med bronkial lavage før man antager non-T2 astma hos patienter i højdosis inhalationssteroid behandling.
Bevaret eller nedsat lungefunktion
- (FEV1<80% eller FEV1
Overvægt
- BMI>30
2.2. Trin 2. Behandlingsbarrierer
2.2.1. Sygdomsforståelse
Manglende forståelse af astma sygdommen, vigtigheden af at tage behandlingen som ordineret, justere ved forværringer og undgå triggers kan være en væsentlig årsag til utilstrækkelig astmakontrol27. Det er derfor vigtigt at forsøge at opnå et billede af patients sygdomsforståelse som en del af anamnese optagelsen.
2.2.2. Medicin-adhærens
Vurdering af medicin-adhærens udgør en essentiel del af udredningen hos patienter med mulig svær astma. Et dansk studie viste, at 42.5 % af patienter med mulig svær astma havde indløst færre end 80% af deres udskrevne recepter på ICS4. Dårlig adhærens er associeret til nedsat astma kontrol28,29 og risiko for at blive unødvendigt øget i astmamedicin (fx opstart i peroral prednisolon) med deraf øget risiko for bivirkninger30.
Adhærens bør som minimum vurderes ved anamnese optagelsen. Det er vigtig at spørge ind til brug af medicin på en fordomsfri måde. Foster scoren er en simpel anamnestisk score, som kan bruges til at vurdere adhærens ved spørgsmålet: ”Hvor mange dage ud af 7 tager du din medicin som anbefalet?”. Start med 0, scoren opgøres som dage/731. Ulempen ved selvrapporteret brug af medicin er tendens til overrapportering. Derfor bør vurdering af adhærens også suppleres med vurdering af receptindløsning af astmamedicin via FMK-online.dk. Der er evidens for, at adhærens under 80% er associeret med øget risiko for eksacerbationer. Derfor bruges ofte en grænse på 80% af indløste/ordinerede doser over det seneste år, som mål for om patienten er adhærent til behandlingen.
Ved utilstrækkelig adhærens søges årsagen afdækket: pris, frygt for bivirkninger, manglende forståelse af behandlingsprincipper.
2.2.3. Inhalationsteknik
Forkert inhalationsteknik er hyppig (20-60 %)2–4 selv hos patienter i højdosis astma behandling og medfører nedsat astmakontrol32 og bør altid kontrolleres som led i en systematisk udredning. Patienter med svær astma får ofte forskellige inhalatorer, hvilket øger risikoen for fejl. Studier har vist at instruktion i inhalationsteknik bør foretages hyppigt, for at sikre korrekt teknik, idet fejl ofte kommer igen27. Inhalationsteknik bør derfor vurderes systematisk hver gang patienten kommer i ambulatoriet1. Man kan med fordel anvende en checkliste, der sikrer at alle trin i inhalationen gøres korrekt. (Se bilag: ”Checkliste til kontrol af inhalationsteknik”). Instruktion i inhalationsteknik ved læge eller sygeplejerske kan suppleres med instruktionsvideoer, som findes for alle inhalatorer på www.medicin.dk, samt på apotek (Påføres recept).
| Tabel 4. Hyppige komorbiditeter hos patienter med svær astma inkl. relevante undersøgelser og behandling | ||
| Komorbiditet | Test | Behandling |
| Rhinosinuitis /nasale polypper (50%)37 | CT af bihuler
Endoskopisk rhinoskopi (ØNH-vurdering) |
Saltvands skylning
Nasal steroid spray/dråber Kirurgi |
| Allergisk rhinoconjuctivitis (70%37*)
(*Positiv priktest) |
Anamnese + priktest/ specifik IgE | Nasal steroid
Antihistaminer LTRA |
| KOL (20%)38 | Anamnese, rygehistorik HRCT, DLCO | LAMA
Rehabilitering |
| Bronkiektasier (25-40%)39,40 | HRCT | PEP-fløjte, saltvandsinhalation
lavdosis makrolid |
| ABPA (1-2%)41 | Total IgE, Aspergillus Fumigatus IgE+IgG, blod eosinofile, HRCT(bronki-ektasier) | Prednisolon, itraconazol, omalizumab |
| Dysfunktio-nel vejrtræk-ning (19-52%)34,42 | Anamnese
Nijmegen spørgeskema BPAT43 Hyperventilationstest |
Fysioterapi |
| Angst/depres-sion (4-17%)9,44 | Psykiatrisk vurdering | Medicinsk behandling
Psykoterapi |
| Obstruktiv søvnapnø (31%)45 | Screening med Berlin spørgeskema
Polysomnografi |
Vægttab
CPAP |
| Overvægt (37%)12 | BMI | Diætist |
| ILO46 (32-50%)34,47,48 | Screening med Pittsburg VCD-index49
Kontinuerlig laryngoskopi under anfald |
Talepædagog |
| Osteoporose | Dexa scanning minimum hvert 2. år | Kalk+vitamin D; bisfosfona-ter |
| *Risiko for falsk negativ test ved ikke-syre betinget refluks.
ABPA: Allergisk bronkopulmonal aspergillose; BMI: Body Mass Index; CPAP: Continuous Positive Airway Pressure; ILO: inducerbar layreal obstruktion; KOL: Kronisk obstruktiv lungesygdom; LAMA: Langtidsvirkende antikolinergikum; LTRA: Leukotrien antagonist |
||
2.3. Trin 3. Triggers og forværrende faktorer
2.3.1. Triggers
Allergen eksponering kan i lighed med mildere astma forværre symptomer, og eventuelle relevante ekspositioner bør afdækkes gennem anamnesen.
Rygning er en væsentlig trigger af symptomer hos astma patienter, og medfører øget tab af lungefunktion over tid. Det er derfor af største vigtighed at adressere vigtigheden af rygestop ydermere bør passiv tobakseksposition undgås.
Erhverv. Der bør optages en erhvervs anamnese med henblik på om der sker forværring af symptomer ved ophold på arbejdspladsen. Ved mistanke om erhvervsbetinget astma bør patienten henvises til en arbejdsmedicinsk vurdering (Se retningslinje ang. Erhvervsbetinget astma).
Medicin. Der spørges til forværring af astma symptomer ved brug af NSAID præparater samt acetylsalicylsyre (NSAID-exacerbated respiratory disease)33. Beta-blokkere kan forværre astmasymptomer og tør hoste kan være bivirkning til ACE-hæmmere.
2.3.2. Komorbiditeter
Hos både patienter med difficult-to-treat astma såvel som ved reel svær astma ses komorbiditeter meget hyppigt4,34,35. Nogle komorbiditeter kan imitere astma symptomer og andre kan medføre manglende astma kontrol34,36. De hyppigste komorbiditeter inklusiv forslag til udredning og behandling er opsummeret i tabel 4. Osteoporose er en hyppig bivirkning til steroid eksposition. Derfor bør dexa-scanning udføres hvert 2. år hos disse patienter.
3. BEHANDLING AF SVÆR ASTMA
Den overordnede behandling af svær astma består af tre komponenter:
1. Non-farmakologisk:
- Optimering af adhærens, inhalationsteknik
- Sikring af god sygdomsforståelse (uddannelse, skriftlig astma plan)
- Fjerne miljømæssige triggers, rygestop
2. Behandling af komorbiditeter (se tabel 4)
3. Astma behandling
Behandlingsbarrierer, triggers og komorbiditeter bør så vidt muligt adresseres før en eventuel intensivering af den medicinske behandling (Figur 3).
3.1. Farmakologisk behandling af svær astma
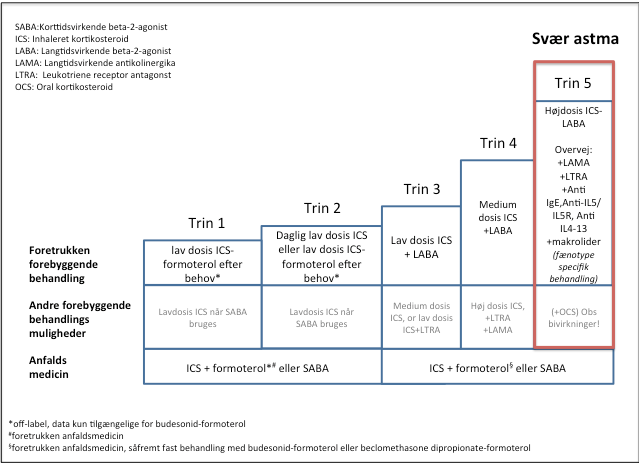
Patienter med svær astma er per definition i behandling svarende til GINA step 5 (Figur 3)1,8. Biologiske behandlinger til svær astma er beskrevet i særskilt retningslinje.
Figur 3: Trinvis astma behandling iht. 2019 GINA1
(Figur adapteret fra ”Nordic Severe Asthma Network Pocket Guide: Systematic assessment and management of possible severe asthma in adults15)
3.1.1. Optimering af Step 5 behandling
Figur 4 viser behandlingsstrategi hos patienter med svær astma. Før overvejelse af tillæg af biologiske behandlingsmuligheder, bør der forsøges optimering af inhalationsmedicin (fx skift fra pulver til spray eller omvendt eller overvejelse af fx finpartikel ICS) samt tillæg af LAMA (især hvis tendens til eksacerbationer eller nedsat lungefunktion)50, LTRA (eksempelvis ved allergisk rhinitis1 eller ved sen debuterende eosinofil astma med nasale polypper og ASA/NSAID intolerance (N-ERD)33) eller teofyllin. I forbindelse med justering af behandlingen bør det også overvejes, om bedre behandlingseffekt og lavere bivirkningsrisiko, herunder ikke mindst systemisk steroideffekt, kan opnås ved valg/tillæg af andre lægemidler inden for samme gruppe af lægemidler. Patienter med svær astma bør tilbydes influenza vaccination.
Hos patienter uden objektive tegn til aktiv astma sygdom (normal lungefunktion, ingen hyperreaktivitet eller reversibilitet, lav FeNO og blod-eos) er det væsentligt, at der gøres et forsøg på at nedtrappe behandlingen, hvilket dog skal gøres under tæt klinisk opfølgning.
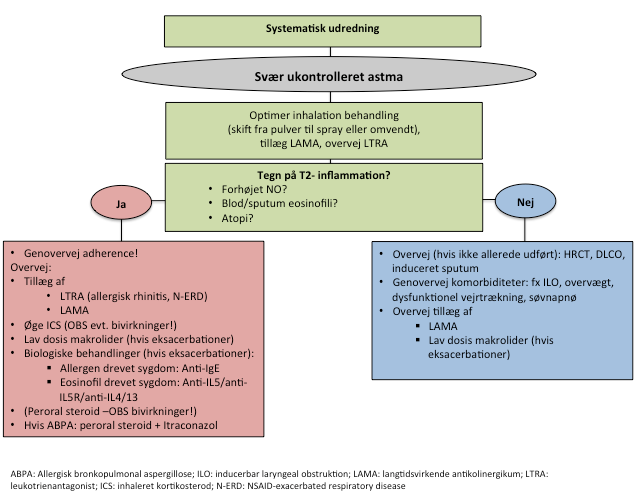
Hvis patienten fortsat har nedsat astma kontrol trods dette overvejes forskellige behandlingsstrategier afhængig af den inflammatoriske fænotype (T2 versus nonT2) (Figur 4).
Figur 4: Oversigt over behandlingsmuligheder til patienter med svær astma afhængig af tilstedeværelse af T2 inflammation.
3.1.2. Nedsat astma kontrol trods optimeret step 5 behandling + tegn til T2 inflammation
Biologisk behandling:
Nævnes kun overordnet her, for yderligere detaljer henvises til DLS retningslinje for behandling af svær astma med biologiske lægemidler
Anti-IgE (omalizumab): Behandlingen er indiceret til patienter med hyppige eksacerbationer, samt en verificeret helårsallergi.
Anti-IL5 (mepolizumab, reslizumab)/Anti-IL5R (benralizumab) samt Anti IL4/13 dupilumab): Indiceret til patienter med eosinofil astma med hyppige eksacerbationer
Makrolider
Langvarig behandling med lavdosis makrolid har vist at reducere eksacerbationer hos patienter med eosinofil såvel som non-eosinofil astma51 Behandlingen bør altid gives protokolleret, dvs. med en prædefineret opfølgning af symptomer, eksacerbationer og lungefunktion.
Typisk anvendes azithromycin, 250-500 mg 3 x ugentligt (f.eks. mandag, onsdag og fredag) i 8-12 uger. Vær opmærksom på bivirkninger såsom hørenedsættelse, arytmier og forlængelse af QT-interval. Derfor bør der før opstart tages EKG (arytmi og QT-interval > 450ms er kontraindikationer) – samt laves høreprøve, såfremt patienten har tegn til hørenedsættelse (relativ kontraindikation).
Patienter bør, såfremt der skønnes at være effekt af behandlingen, følges op hver 3. måned med EKG og ved tegn til høre nedsættelse henvises til høre-undersøgelse. Ligesom der skal udspørges om svimmelhed, tinnitus og gastrointestinale bivirkninger ved fortsat behandling.
Peroralt steroid
Bør undgås. Hos enkelte patienter med hyppige eksacerbationer kan det undtagelsesvist være nødvending for at opretholde astma kontrol (typisk 5-10 mg dagligt). Før opstart bør det sikres, at patienten er adhærent til den øvrige astma behandling. Der foreligger ikke evidens for effekten af behandlingen og behandlingen er forbundet med betydelig risiko for vigtige bivirkninger såsom eksempelvis overvægt, osteoporose, binyrebark insufficiens og diabetes30. Ligeledes har et nyt studie vist, at kronisk brug af peroralt steroid øger all-cause mortaliteten hos astma patienter52. Ved brug skal indikationen revurderes jævnligt, ligesom der bør foretages DEXA scanning hvert 2. år.
Itraconazol
Itraconazol anvendes i behandlingen af ABPA, som er velbeskrevet hos patienter med svær astma (se DLS retningslinje for ABPA). Kan overvejes ved SAFS (severe asthma with fungal sensitisation), om end evidensen er mindre.
3.1.3. Nedsat astma kontrol trods optimeret step 5 behandling uden T2 inflammation
Makrolider
Som nævnt ovenfor har lavdosis makrolid behandling vist at reducere eksacerbationer hos patienter med både eosinofil og non-eosinofil astma. Angående dosering og bivirkninger se afsnittet ”3.1.2 Nedsat astma kontrol trods optimeret step 5 behandling + tegn til T2 inflammation
4. DANSK SVÆR ASTMA REGISTER – DSAR
DSAR blev initieret af Dansk Lungemedicinsk Selskab i 2017, og ledes af repræsentanter fra de lungemedicinske afdelinger i Danmark.
DSAR er en landsdækkende behandlings- og forskningsdatabase over patienter med svær astma i Danmark. Formålet er at indsamle kliniske oplysninger om patienter med svær astma, herunder at alle patienter, som påbegynder biologisk behandling for svær astma, registreres i databasen. Hensigten er at monitorere effekten af de biologiske behandlinger til svær astma samt via forskning skabe en bedre forståelse for sygdommen og forbedre behandlingen af svær astma.
5. REFERENCER
- Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention 2019. available www.ginasthma.org, Date last Updat 2019 Last accessed Sep 1 2019.
- Hekking P-PW, Wener RR, Amelink M, Zwinderman AH, Bouvy ML, Bel EH. The prevalence of severe refractory asthma. J Allergy Clin Immunol 2015; 135: 896–902.
- Meer A Van Der, Pasma H, Kempenaar-okkema W, Pelinck J-A, Schutten M, Storm H et al. A 1-day visit in a severe asthma centre : effect on asthma control , quality of life and healthcare use. Eur Respir J 2016; 48: 726–733.
- von Bülow A, Backer V, Bodtger U, Soes-Petersen NU, Vest S, Steffensen I et al. Differentiation of adult severe asthma from difficult-to-treat asthma – Outcomes of a systematic assessment protocol. Respir Med 2018; 145: 41–47.
- Heaney LG, Conway E, Kelly C, Johnston BT, English C, Stevenson M et al. Predictors of therapy resistant asthma: outcome of a systematic evaluation protocol. Thorax 2003; 58: 561–6.
- Bel EH, Sousa A, Fleming L, Bush A, Chung KF, Versnel J et al. Diagnosis and definition of severe refractory asthma: an international consensus statement from the Innovative Medicine Initiative (IMI). Thorax 2011; 66: 910–917.
- Chung KF, Wenzel SE, Brozek JL, Bush A, Castro M, Sterk PJ et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J 2014; 43: 343–373.
- Holguin F, Cardet JC, Chung KF, Diver S, Ferreira DS, Gaga M et al. Early View Task Force Report Management of Severe Asthma : a European Respiratory Society / American Thoracic Society Guideline Management of Severe Asthma : a European Respiratory Society / American Thoracic Society Guideline. Eur Respir J 2019; in press: https://doi.org/10.1183/13993003.00588-2019.
- von Bülow A, Kriegbaum M, Backer V, Porsbjerg C. The prevalence of severe asthma and low asthma control among danish adults. J Allergy Clin Immunol Pr 2014; 2: 759–767.
- Backman H, Jansson S-A, Stridsman C, Eriksson B, Hedman L, Eklund B-M et al. Severe asthma — A population study perspective. Clin Exp Allergy 2019; 49: 819–828.
- Ilmarinen P, Tuomisto LE, Niemel O, Kankaanranta H. Prevalence of Patients Eligible for Anti-IL-5 Treatment in a Cohort of Adult-Onset Asthma. J Allergy Clin Immunol Pract 2019; 7: 165-174.e4.
- Moore WC, Bleecker ER, Curran-Everett D, Erzurum SC, Ameredes BT, Bacharier L et al. Characterization of the severe asthma phenotype by the National Heart, Lung and Blood Institute’s Severe Asthma Research Program. J allergy Clin Immunol 2007; 119: 405–413.
- O’Neill S, Sweeney J, Patterson CC, Menzies-gow A, Niven R, Mansur AH et al. The cost of treating severe refractory asthma in the UK : an economic analysis from the British Thoracic Society Dif fi cult Asthma Registry. Thorax 2015; 70: 376–378.
- Sweeney J, Patterson CC, Menzies-Gow A, Niven RM, Mansur AH, Bucknall C et al. Comorbidity in severe asthma requiring systemic corticosteroid therapy: cross-sectional data from the Optimum Patient Care Research Database and the British Thoracic Difficult Asthma Registry. Thorax 2016; 71: 339–346.
- von Bülow A, Sverrild A, Ulrik C, Skjold T, Backer V, Hilberg O et al. The Nordic Severe Asthma Network: Pocket guide: Systematic assessment and management of possible severe asthma in adults. available www.nsan.one, last updated 2020; accessed Feb 1 2020
- Collop NA, Anderson WM, Boehlecke B, Claman D, Goldberg R, Gottlieb DJ et al. Clinical Guidelines for the Use of Unattended Portable Monitors in the Diagnosis of Obstructive Sleep Apnea in Adult Patients. J Clin Sleep Med 1997; 3: 737–747.
- Coates AL, Wanger J, Cockcroft DW, Culver BH, Carlsen K-H, Diamant Z et al. ERS technical standard on bronchial challenge testing: general considerations and performance of methacholine challenge tests. Eur Respir J 2017; 49: 1–17.
- Lambrecht BN, Hammad H. The immunology of asthma. Nat Immunol 2015; 16: 45–56.
- Moore WC, Hastie AT, Li X, Li H, Busse WW, Jarjour NN et al. Sputum neutrophil counts are associated with more severe asthma phenotypes using cluster analysis. J Allergy Clin Immunol 2013. doi:10.1016/j.jaci.2013.10.011.
- Shaw DE, Sousa AR, Fowler SJ, Fleming LJ, Roberts G, Corfield J et al. Clinical and inflammatory characteristics of the European U-BIOPRED adult severe asthma cohort. Eur Respir J 2017; 49: doi.10.1183/13993003.00779-2015.
- Pavord ID, Afzalnia S, Menzies-Gow A, Heaney LG. The current and future role of biomarkers in type 2 cytokine-mediated asthma management Experimental Allergy. Clin Exp allergy 2017; : 148–160.
- Fahy J V. Type 2 inflammation in asthma — present in most, absent in many. Nat Rev Immonol 2015; 15: 57–65.
- Fowler SJ, Tavernier G, Niven R. High blood eosinophil count predict sputum eosinophlia in patients with severe asthma. J allergy Clin Immunol 2015; 135: 822–4.e2.
- Pavord ID, Korn S, Howarth P, Bleecker ER, Buhl R, Keene ON et al. Mepolizumab for severe eosinophilic asthma ( DREAM ): a multicentre , double-blind , placebo-controlled trial. Lancet 2012; 380: 651–659.
- Dweik RA, Boggs PB, Erzurum SC, Irvin CG, Leigh MW, Lundberg JO et al. An Official ATS Clinical Practice Guideline : Interpretation of Exhaled Nitric Oxide Levels ( FeNO ) for Clinical Applications. Am J Respir Crit Care Med 2011; 184: 602–615.
- ARIA ( Allergic Rhinitis and its Impact on Asthma ) 2008 Update. available www.whiar.org, Date last Updat 2016, accessed June 1 2019.
- McDonald VM, Vertigan AE, Gibson PG. How to set up a severe asthma service. Respirology 2011; 16: 900–11.
- Murphy AC, Proeschal A, Brightling CE, Wardlaw AJ, Pavord I, Bradding P et al. The relationship between clinical outcomes and medication adherence in difficult-to-control asthma. Thorax 2012; 67: 751–3.
- Gamble J, Stevenson M, Mcclean E, Heaney LG. The Prevalence of Nonadherence in Difficult Asthma. Am J Respir Crit Care Med 2009; 180: 817–822.
- Ekström M, Nwaru BI, Hasvold P, Wiklund F, Telg G, Janson C. Oral corticosteroid use , morbidity and mortality in asthma : A nationwide prospective cohort study in Sweden. Allergy 2019; 74: 2181–2190.
- Foster JM, Smith L, Bosnic-Anticevich SZ, Usherwood T, Sawyer SM, Rand CS et al. Identifying patient-specific beliefs and behaviours for conversations about adherence in asthma. Intern Med J 2012; 42: e136-44.
- Melani AS, Bonavia M, Cilenti V, Cinti C, Lodi M, Martucci P et al. Inhaler mishandling remains common in real life and is associated with reduced disease control. Respir Med 2011; 105: 930–938.
- Kowalski ML, Agache I, Bavbek S, Bakirtas A, Ni E, Sanchez-borges M et al. Diagnosis and management of NSAID ‐ Exacerbated Respiratory Disease (N ‐ ERD) — a EAACI position paper*. Allergy 2019; : 28–39.
- Tay TR, Radhakrishna N, Hore-Lacy F, Smith C, Hoy R, Dabscheck E et al. Comorbidities in difficult asthma are independent risk factors for frequent exacerbations, poor control and diminished quality of life. Respirology 2016; 21: 1384–1390.
- ten Brinke A, Sterk PJ, Masclee AAM, Spinhoven P, Schmidt JT, Zwinderman AH et al. Risk factors of frequent exacerbations in difficult-to-treat asthma. Eur Respir J 2005; 26: 812–818.
- Porsbjerg CM, Menzies-Gow A. Co-morbidities in severe asthma: Clinical impact and management. Respirology 2017; 22: 651–661.
- Schleich F, Brusselle G, Louis R, Vandenplas O, Michils A, Pilette C et al. ScienceDirect Heterogeneity of phenotypes in severe asthmatics . The Belgian Severe Asthma Registry ( BSAR ). Respir Med 2014; 108: 1723–1732.
- Gibson PG, Mcdonald VM. Asthma – COPD overlap 2015 : now we are six. 2015; : 683–691.
- Bisaccioni C, Aun MV, Cajuela E, Kalil J, Agondi RC, Giavina-Bianchi P. Comorbidities in severe asthma: frequency of rhinitis, nasal polyposis, gastroesophageal reflux disease, vocal cord dysfunction and bronchiectasis. Clinics 2009; 64: 769–773.
- Gupta S, Siddiqui S, Haldar P, Raj JV, Entwisle JJ, Wardlaw AJ et al. Qualitative Analysis of High-Resolution CT Scans in Severe Asthma. Chest 2009; 136: 1521–1528.
- Greenberger P a., Bush RK, Demain JG, Luong A, Slavin RG, Knutsen AP. Allergic Bronchopulmonary Aspergillosis. J Allergy Clin Immunol Pract 2014; 2: 703–708.
- Haldar P, Pavord ID, Shaw DE, Berry MA, Thomas M, Brightling CE et al. Europe PMC Funders Group Cluster Analysis and Clinical Asthma Phenotypes. 2014; 178: 218–224.
- Todd S, Walsted ES, Grillo L, Livingston R, Menzies-Gow A, Hull JH. Novel assessment tool to detect breathing pattern disorder in patients with refractory asthma. Respirology 2017; : doi: 10.1111/resp.13173.
- Haldar P, Pavord ID, Shaw DE, Berry M a, Thomas M, Brightling CE et al. Cluster analysis and clinical asthma phenotypes. Am J Respir Crit Care Med 2008; 178: 218–24.
- Teodorescu M, Broytman O, Curran-Everett D, Sorkness RL, Crisafi G, Bleecker ER et al. Obstructive Sleep Apnea Risk, Asthma Burden, and Lower Airway Inflammation in Adults in the Severe Asthma Research Program (SARP) II. J Allergy Clin Immunol Pract 2015; 3: 566-575.e1.
- Halvorsen T, Walsted ES, Bucca C, Bush A, Cantarella G, Friedrich G et al. Inducible laryngeal obstruction: an official joint European Respiratory Society and European Laryngological Society statement. Eur Respir J 2017; 50: DOI: 10.1183/13993003.02221-2016.
- Low K, Lau KK, Holmes P, Crossett M, Vallance N, Phyland D et al. Abnormal Vocal Cord Function in Difficult-to-Treat Asthma. Am J Respir Crit Care Med 2011; 184: 50–56.
- Hull J, Walsted ES, Pavitt M, Menzies-gow A, Backer V, Sandhu G. High Prevalence of Laryngeal Obstruction during Exercise in Severe Asthma. Am J Respir Crit Care Med 2019; 199: 538–542.
- Traister RS, Fajt ML, Landsittel D, Petrov AA. A Novel Scoring System to Distinguish Vocal Cord Dysfunction From Asthma. J Allergy Clin Immunol Pract 2014; 2: 65–69.
- Kerstjens HAM, Moroni-Zentgraf P, Tashkin DP, Dahl R, Paggiaro P, Vandewalker M et al. Tiotropium improves lung function, exacerbation rate, and asthma control, independent of baseline characteristics including age, degree of airway obstruction, and allergic status. Respir Med 2016; 117: 198–206.
- Gibson PG, Yang IA, Upham JW, Reynolds PN, Hodge S, James AL et al. Effect of azithromycin on asthma exacerbations and quality of life in adults with persistent uncontrolled asthma (AMAZES): a randomised, double-blind, placebo-controlled trial. Lancet 2017; 390: 659–668.
- Lee H, Ryu J, Nam E, Chung SJ, Yeo Y, Park DW et al. Increased mortality in patients with corticosteroid-dependent asthma : a nationwide population-based study. Eur Respir J 2019; 54: https://doi.org/10.1183/13993003.00804-2019.