1.1. DEFINITION OG FOREKOMST
Allergisk bronkopulmonal aspergillose (ABPA) er karakteriseret ved astma, eosinofili og røntgen-forandringer med flygtige lungeinfiltrater og/eller bronkiektasier, som følge af en kompleks hyper-sensibilisering overfor kolonisering med Asper-gillus fumigatus (AF) i bronkiesystemet.
Prævalensen af ABPA ved patienter med astma er i udenlandske studier estimeret til at være ca. 2% og ved patienter med svær astma med behov for systemisk kortikosteroid helt op til 7-14%. Der foreligger endnu ikke konsistente epidemio-logiske data fra Danmark omkring ABPA iblandt patenter med astma. Iblandt patienter med cystisk fibrose (CF) har man i et dansk observationsstudie opgjort 5-års prævalensen for ABPA hos AF koloniserede patienter til knap 11%, men i udenlandske studier er prævalensen af ABPA hos CF patienter vurderet at være op til ca. 15%.
1.2. ÆTIOLOGI
Aspergillus species er saprofytære skimmel-svampe, der vokser ved sporedannende hyfer, og som findes udbredt overalt i naturen (jord, plantedele, støv), men også i hospitalsmiljø (luftfugtere, ventilationsanlæg). Op imod 22% af det totale antal luftbårne svampesporer menes at stamme fra Aspergillus svampe. Der findes ca. 250 Aspergillus species, hvoraf få er humant patogene, herunder AF.
1.2.1. Patogenese
Hos raske individer vil inhalation af svampesporer normalt elimineres effektivt via sekretorisk IgA i bronkialvæske samt IgG i blod. Hos især astmatikere, atopikere og patienter med CF vil inhalation af svampesporer fra AF give anledning til kolonisering af bronkiesystemet resulterende i en immunologisk og inflammatorisk reaktion i bronkier og omkringliggende parenkym. Den immunologiske reaktion skyldes hypersensibili-sering overfor AF medførende hypersensivitets-reaktioner af type I og III med mediering af hhv. IgE og IgG samt IgA, hvorimod den inflammatoriske reaktion skyldes en Th2 CD4+ T-celle medieret aktivering af primært eosino-filocytter. Den eosinofile inflammation i bronkie-systemet kan være starten på flere af ABPA’s kliniske og parakliniske karakteristika: Bronkial inflammation à konsolidering og mukusplugs à endobronkial obstruktion med astmasymptomer à bronkiektasier à bronkievægfortykkelse à mikro-abscesser à fibrose. Ved ABPA ses ikke hyfeindvækst i submukosa, der i så fald vil indikere en invasiv pulmonal aspergillose. Ved hypersensibilisering overfor andre Aspergillus species end AF benævnes tilstanden ”allergisk bronkopulmonal mykose (ABPM).”
1.2.2. Klassifikation
ABPA kan på baggrund af sin kliniske og radiologiske præsentation inddeles i 5 stadier. De forskellige stadier præsenterer sig ikke nødvendigvis kontinuert (se tabel).
| Stadie
|
Beskrivelse |
Typisk klinik |
Migrerende infiltrater |
Eosinofili |
AF-specifik IgG el. præcipitiner |
Total IgE |
| I | Akut | Feber, vægttab, produktiv hoste, pibende/hvæsende
Vejrtrækning |
+ | + | + | +++ |
|
II
|
Remission | Asymptomatisk | – | – | +/- | + |
| III | Exacerbation | Som i akut stadie | + | + | + |
+++
|
| IV
|
Kortikosteroid-
afhængig astma el. ABPA * |
Som i akut stadie | +/- | +/- | +/- | ++ |
| V | Fibrose / end stage
(kan udvikle sig til kronisk pulmonal aspergillose) |
Fikseret luftvejsobstruktion,
type II respirations- insufficiens, cor pulmonale |
+
(bronkiektasier, fibrose, bulløse el. kavitære opklaringer) |
– | +/- | + |
* To fænotyper:
- Kortikosteroidafhængig astma (astma symp-tomkontrol kan kun opnås med tillæg af steroid)
- Kortikosteroidafhængig ABPA (sygdoms-aktiviteten kan kun undertrykkes med tillæg af steroid)
1.3. UDREDNING
1.3.1. Klinik
Typisk præsenterer patienten sig med symp-tomer på både astma og pneumoni.
- Astma: Periodisk hoste samt pibende/ hvæsende respiration.
- Pneumoni: Nedsat almen tilstand grundet febrilia. Hoste med brun-grønt mukopurulent ekspektoration, som kan indeholde brun-sorte trådformede mukusplugs, der repræ-senterer inflammatoriske afstøbninger fra én el. flere segmentbronkier. Sjældent inspira-toriske stingsmerter og hæmoptyse.
1.3.2. Paraklinik
- Blod: Eosinofili (NB: Eosinofilien kan være sløret af pågående højdosis inhalations-steroid el. systemisk kortikosteroidbehand-ling), forhøjet total-IgE, forhøjet AF-specifik IgE, forhøjet AF-specifik IgG (=præcipi-terende antistoffer overfor AF). AF-specifik IgE og IgG analyseres bl.a. af Phadia/ TermoFischer. Aspergillus specifik IgG for hele Aspergillus slægten kan bl.a. bestilles på SSI. Sidstnævnte kan således være forhøjet uden, at AF-specifik IgE og IgG nødvendigvis behøver at være det. I så fald indikerer det tilstanden ABPM.
- Hud: positiv priktest overfor AF i stedet for AF-specifik IgE
- Ekspektorat: Positiv dyrkning af AF. Kan ved især CF patienter med andre samtidige infektioner være vanskelig at fremdyrke.
- Bronkialskyllevæske og BAL: Positiv dyrk-ning af AF, eosinofili på > 25% af samlet celletal, mikroskopisk synlige hyfer, og positiv Aspergillus galactomannan antigen repræsenterende ”rest af hyfevækst” fra specifikt AF. Idet der kun måles på frit antigen er Aspergillus galactomannan antigen ofte negativ i blodet hos patienter med højt niveau af forhøjet AF-specifik IgG. Aspergillus galactomannan antigen kan bestilles på SSI ligesom flere lokale mikrobiologiske afdelinger også besidder mulighed for denne analyse.
NB: Bør ved immuninkompetente patienter eller patienter med svære kroniske lunge-forandringer rejse mistanke om invasiv pulmonal aspergillose og foranledige under-søgelse med Aspergillus galactomannan antigen i blod. - Bronkoskopiske (EBNAB, TBNAB, MB og TBB) samt thorakoskopiske biopsier: Positiv vækst af AF. Mikroskopisk påvisning af hyfeindvækst i bronkievæg vil repræsentere invasiv sygdom (invasiv pulmonal asper-gillose, hvilket er guldstandarden ved diag-nostik af kroniske og invasive pulmonale aspergilloser).
- Radiologi:
- Røntgen af thorax med migrerende infiltrater.
- HRCT med migrerende infiltrater, cylindriske centrale bronkiektasier med bronkial vægfortykkelse i primært overlapper, endobronkial mukusplugob-struktion (”tandpasta skygger”) med-førende subsegmentære atelektaser, matglastegning, mosaiktegning og air-trapping.
- Lungefunktionsundersøgelse: Hyppigst luft-vejsobstruktion med nedsat FEV1/FVC-ratio og øget RV. Et blandet obstruktivt og restriktivt mønster kan dog ses afhængigt af stadie. Astmadiagnosen sandsynliggøres ved konventionelle diagnostiske tests herfor (se separate instrukser)
1.4. DIAGNOSE
1.4.1 Major kriterier:
≥ 6 af 8 major kriterier er forenelig med klassisk ABPA:
- Dokumenteret astma
- Migrerende lungeinfiltrater på røntgen af thorax el. HRCT
- Centrale bronkiektasier på røntgen af thorax el. HRCT
- Positiv priktest positiv for AF
- ↑ IgE i serum (typisk > 1.000 IU/mL)
- ↑ AF-specifik IgG og IgE i serum
- Eosinofili (typisk > 1.000 celler/μL sv.t. 1.0 x 109 celler/L)
- Præcipiterende antistoffer (IgG) in serum
ABPA kan endvidere klassificeres som ABPA-CB ved tilstedeværelse af centrale bronkiektasier, og som seropositiv ABPA-S uden tilstedeværelse af centrale bronkiektasier.
1.4.2 Minimumskriterier for diagnostik af ABPA-CB:
- Dokumenteret astma
- Positiv prik test for AF
- ↑ IgE i serum
- ↑ AF-specifikke IgG og IgE i serum
- Centrale bronkiektasier
1.4.3 Minimumskriterier for diagnostik af ABPA-S:
- Dokumenteret astma
- Positiv prik test for AF
- ↑ IgE i serum
- ↑ AF-specifikke IgG og IgE i serum
- Migrerende infiltrater på røntgen af thorax el. HRCT
Se endvidere figur 1.
Figur 1
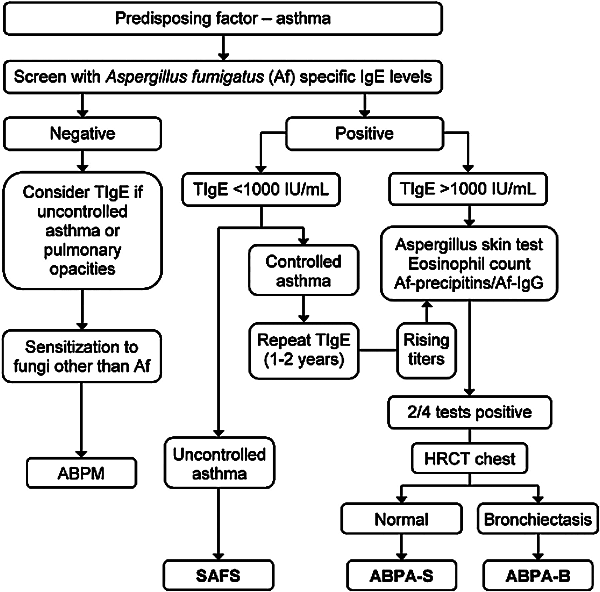
Figur 1
Diagnostisk flow-chart baseret på:
Kosmidis C, Denning DW. The clinical spectrum of pulmonary aspergillosis. Thorax 2015;70:270-7.
Forkortelser:
Af: Aspergillus fumigatus*
ABPA-B: Bronkiektasi-positiv allergisk bronkopulmonal aspergillose
ABPA-S: Serum-positiv allergisk bronkopulmonal aspergillose.
ABPM: Allergisk bronkopulmonal mykosis
CF: Cystisk fibrose
SAFS: Svær astma med fungal sensibilisering
1.5. BEHANDLING
Behandling af ABPA har til formål at behandle akutte exacerbationer og forhindre sygdoms-progression med udvikling af bronkiektaser og fibrose. Dette opnås ved en målrettet behandling, der sigter mod:
- suppression af den immunologiske aktivitet
- antifungal eradikationsbehandling af AF infektion
1.5.1. Immunsupprimerende behandling:
Behandling med systemisk glukokortikosteroid er første valg, og har gunstig effekt ved:
- begrænsning af den immunologiske reaktion (nedsat hypersensibilisering à reduktion af total-IgE samt AF-specifik IgG og IgE)
- antiinflammatorisk virkning (reduktion af endobronkial inflammation à regression af radiologisk påviste infiltrater og mukusplug-ging samt bedret astma symptomkontrol)
Der foreligger ikke solid evidens for anbefalet behandlingsvarighed og dosering med systemisk glukokortikosteroid. I forskellige studier er det dog observeret, at en længere behandlingsvarighed med højdosis prednisolon er associeret med en højere grad af remission (stadie II) og en lavere prævalens for udvikling af kortikosteroidafhængig ABPA (stadie IV). Ligeledes er det observeret at lave prednisolondoser er associeret med en øget risiko for exacerbationer (stadie III) og behandlingssvigt. Således er det foreslået, at prednisolon startdosis baseres på baggrund af vurderet ABPA-stadie med herefter langsom udtrapning med dosisreduktion hver 2. uge under samtidig monitorering af total-IgE, der anvendes som surrogatmarkør for sygdomsaktivitet:
- stadie I (akut): ½-1 mg prednisolon/kg pr. døgn i 2 uger
- stadie II (remission): Ingen indikation for prednisolonbehandling
- stadie III (exacerbation): ½-1 mg prednisolon/kg pr. døgn i 2 uger
- stadie IV (kortikosteroidafhængig ABPA el. astma): ½-1 mg prednisolon/kg pr. døgn i 2 uger
- stadie V (fibrose/end-stage): Ingen indikation for prednisolonbehandling
Hos børn med ABPA og CF har man kasuistisk forsøgt behandling med methylprednisolon pulskure. Denne behandlingsform har udvist god behandlingsrespons og mindre toxicitet, og kan således overvejes hos patienter med uacceptable prednisolonbivirkninger. Behandlingen må fortsat anses for eksperimentel indtil data fra rando-miserede og/eller longitudinelle studier foreligger.
Generelt anbefales flg. retningslinier for beh. med systemisk glukokortikosteroid til ABPA:
- Som oftest initieres behandling sv.t. stadie I og III
- Behandlingsvarighed på mellem 3-6 måne-der, som oftest 4 måneder
- Reduktion til laveste mulige dosis efter behandling af stadie I og III (reduktion med f.eks. 5-10 mg hver 2. uge)
1.5.2. Antifungal eradikationsbehandling:
Foreløbig har to placebokontrollerede rando-miserede kliniske studier dokumenteret et øget behandlingsrespons på følgende effektpara-metre ved brug af per oralt indtaget itraconazol igennem 16 uger:
- reduktion i steroiddosis
- reduktion i total-IgE
- forbedring af LFU
- partiel/komplet remission af røntgenfor-andringer
- reduktion i sputum eosinofile
- reduktion af steroidkrævende exacerba-tioner (stadie III)
Grundet itraconazols meget varierende absorp-tion tilrådes måling af serum-itraconazol m.h.p. dosisjustering til terapeutisk niveau. Samtidig er itraconazol er en potent CYP3A-hæmmer med deraf risiko for øgede plasmakoncentrationer af lægemidler, der nedbrydes af dette enzym. Her bør man specielt være opmærksom på interaktion med inhalationssteroider. Før opstart af itraconazol (eller andre azolpræparater) anbe-fales kontrol af evt. medicinske interaktioner ved opslag på:
- interaktionsdatabasen.dk
- aspergillus.org.uk/content/antifungal-drug-interactions
Generelt anbefales flg. retningslinjer for behand-ling med itraconazol til ABPA:
- startdosis på 400 mg pr. døgn fordelt på to doser med justering efter serumkoncen-tration sv.t. terapeutisk index på > 1 mikrog./mL
- 16 ugers (4 måneders) behandling
- månedlig kontrol af levertal grundet risiko for medikamentel induceret hepatitis
- månedlig kontrol af serum-itraconazol
1.5.3 Astma behandling:
Følger konventionelle retningslinjer for astma-behandling (GINA), se separat instruks
1.5.4. Alternative behandlinger:
Inhalationssteroid har ingen rolle i behandlingen af ABPA, men anbefales alene som supplement til de patienter, der ikke har fuld astma symptomkontrol på systemisk prednisolonbe-handling.
Voriconazol (Vfend®) anbefales til invasiv pulmonal og kronisk nekrotiserende asper-gillose. Der foreligger kun et enkelt studie ved ABPA, som viser at voriconazol er ligeværdigt med steroid, dog uden steroidbivirknigner, og kun marginalt mere effektivt end itraconazol. Da evidensen er begrænset, anbefales det billigere itraconazol fortsat som førstevalg.
Behandling af ABPA med omalizumab (Xolair®) er stadig kontroversielt, men er i et nyligt review inkluderende 30 studier med i alt 102 patienter > 18 år beskrevet at kunne reducere antallet af astmarelaterede symptomer, nedsætte antallet af astma exacerbationer samt reducere behovet for systemisk glukokortikoidbehandling. I dette review fandt man endvidere en signifikant effekt i.f.a. stigende lungefunktion og reduceret total-IgE ved behandling med omalizumab. Omalizumab må dog endnu anses som et steroidbesparende alternativ til behandling af ABPA idet der endnu ikke foreligger randomiserede studier, der kan dokumentere sikkerhedsprofil og/eller kliniske effekt.
Der foreligger endnu ingen entydige studier på, hvorvidt ABPA-patienter kan profitere af behandling med anti-IL5 præparater som reslizumab og mepolizumab, men deres mulige steroidbesparende effekt er beskrevet i case-series samt ved CF-relateret ABPA.
1.6. KONTROL OG OPFØLGNING
Idet total-IgE kan anvendes som surrogatmarkør for sygdomsaktivitet tilstræbes flg. mål for behandlingsrespons og opfølgning:
- opnåelse af en ”stabil” total-IgE sv.t. 35-50% reduktion i.f.t. udgangsværdi ved diagnose
- klinisk og radiologisk bedring
- kontrol af total-IgE hver 2. måned i op til år efter remission
En stigning af den ”stabile” total-IgE indikerer pågående sygdomsaktivitet, og stillingtagen til optitrering af immunsupprimerende behandling bør derfor foretages.
1.7. OPSUMMERING
- Diagnostik: ABPA bør mistænkes ved enhver patient med manglende astma sygdoms-kontrol og lungeinfiltrater
- Behandling: Ca. 4 måneders kombineret systemisk glukokortikosteroid og antifungal behandling
- Kontrol: Månedlig blodprøvekontrol af levertal, serum-Itraconazol og klinisk kontrol under pågående behandling
- Blodprøvekontrol af total-IgE ca. hver 2. måned i ét år efter afsluttet behandling
1.8 DIFFERENTIALDIAGNOSER
- Allergisk astma
- Allergisk bronkopulmonal mykose (forhøjet IgE, men normal AF-specifik IgE og IgG, bronkialskyllevæske og BAL med positiv dyrkning af andre skimmelsvampe)
- Aspergillom (karakteristisk infiltrat)
- Cancer pulmonis (solide infiltrater, evt. med lungemetastaser, B-symptomer)
- Eosinofil granulomatøs polyangiitis (positiv p-ANCA, multiorganpåvirkning)
- Eosinofil pneumoni (normal AF-specifik IgE og IgG)
- Invasiv pulmonal aspergillose (hos immun-inkompetente patienter, positiv Aspergillus galactomannan antigen i blod)
REFERENCER
- Rosenberg M, Patterson R, Mintzer R, et al. Clinical and immunologic criteria for the diagnosis of allergic bronchopulmonary aspergillosis. Ann Intern Med 1977;86:405-14.
- Greenberger PA, Patterson R. Diagnosis and management of allergic bronchopulmonary aspergillosis. Ann Allergy 1986;56:444-8.
- Stevens DA, Schwartz HJ, Lee JY, et al. A randomized trial of itraconazole in allergic bronchopulmonary aspergillosis. N Engl J Med 2000;342:756-62.
- Skov M, Koch C, Reimert CM, et al. Diagnosis of allergic bronchopulmonary aspergillosis (ABPA) in cystic fibrosis. Allergy 2000;55:50-8.
- Wark PA, Hensley MJ, Saltos N, et al. Anti-inflammatory effect of itraconazole in stable allergic bronchopulmonary aspergillosis: a randomized controlled trial. J Allergy Clin Immunol 2003;111:952-7.
- Thomson JM, Wesley A, Byrnes CA, et al. Pulse intravenous methylprednisolone for resistant allergic bronchopulmonary aspergillosis in cystic fibrosis. Pediatr Pulmonol 2006;41:164-70.
- Agarwal R. Allergic Bronchopulmonary Aspergillosis. Chest 2009;135:805-26.
- Patterson K, Strek ME. Allergic bronchopulmonary aspergillosis. Proc Am Thorac Soc 2010;7:237-44.
- Mason RJ, Broaddus VC, Martin TR, et al. Eosinophilic lung diseases. Murray and Nadel’s textbook of respiratory medicine. 5th Philadelphia: Saunders Elsevier; 2010. p. 1484-6.
- Agarwal R, Khan A, Aggarwal AN, et al. Role of inhaled corticosteroids in the management of serological allergic bronchopulmonary aspergillosis (ABPA). Intern Med. 2011;50:855-60.
- Kousha M, Tadi R, Soubani AO. Pulmonary aspergillosis: a clinical review. Eur Respir Rev 2011;20:156-74.
- Li JX, Fan LC, Li MH, Cao WJ, Xu JF. Beneficial effects of Omalizumab therapy in allergic bronchopulmonary aspergillosis: A synthesis review of published literature. Respir Med. 2017;122:33-42.
- aspergillus.org.uk/allergic-bronchopulmonaru-aspergillosis-abpa/
- Agarwal R, Dhooria S, Sehgal IS, et al. A randomized trial of itraconazole vs prednisolone in acute-stage allergic bronchopulmonary aspergillosis complicating asthma. Chest. 2018;153(3):656–64.
- Agarwal R, Dhooria S, Sehgal IS, et al. A randomised trial of voriconazole and prednisolone monotherapy in acute-stage allergic bronchopulmonary aspergillosis complicating asthma. Eur Respir J 2018;52(3):1801159.
- Rapeport WG, Ito K, Denning DW. The role of antifungals in the management of patients with severe asthma. Clin Transl Allergy. 2020;10(1):46.
- Wark P, Hussaini S, Holder C, et al. Omalizumab is an effective intervention in severe asthma with fungal sensitization. J Allergy Clin Immunol Pract. 2020;8(10):3428–33.
- Wardlaw A, Howarth PH, Israel E, et al. Fungal sensitization and its relationship to mepolizumab response in patients with severe eosinophilic asthma. Clin Exp Allergy. 2020;50(7):869–872.
- Lewington-Gower E, Chan L, Shah A. Review of current and future therapeutics in ABPA. Ther Adv Chronic Dis. 2021;12:20406223211047003.
- Tompkins MG, Pettit R. Beyond the Guidelines: Treatment of Allergic Bronchopulmonary Aspergillosis in Cystic Fibrosis. Ann Pharmacother. 2022;56(2):181-192.
- Global Initiative for Asthma: https://ginasthma.org)/