1.1. INTRODUKTION
Ved udredning af uafklaret kronisk hypoksæmi vil man primært fokusere på sygdom i lunger, lungekredsløb og hjerte. Et undersøgelsesprogram for en sådan uafklaret patient omfatter typisk:
- Arteriegasanalyse
- Spirometri med reversibilitetstest
- Udvidet lungefunktionsundersøgelse
- High-resolution computer tomografi (HRCT)
- Gangtest
- Lungeskintigrafi/CT-angiografi af lungekar
- Ekkokardiografi og EKG
- Blodprøver inkl. Autoimmunserologi
- Lungebiopsi og bronkoalveolær lavage
I nogle situationer vil disse undersøgelser ikke danne grundlag for nogen specifik diagnose eller alternativt ikke kunne forklare sværhedsgraden af hypoksæmi. I sådanne tilfælde bør man overveje tilstedeværelsen af en intrapulmonal shunt. Hvis der samtidig findes tegn på leversygdom, skal hepatopulmonalt syndrom (HPS) overvejes. Tilstandens nøjagtige forekomst er ikke kendt og varierer afhængigt af anvendt definition. I visse opgørelser har 10% af patienter med levercirrhose tegn på HPS.
1.2. PATOFYSIOLOGI
Patofysiologien ved HPS kendes ikke i detaljer, men ubalance i produktion og nedbrydning af vasoaktive stoffer i leveren menes at være årsagen. Resultatet er udtalt vasodilatation i lungekredsløbet med deraf følgende fald i ventilation-perfusionsratio (V/Q) resulterende i hypoxæmi og type 1 respirationssvigt. Typisk har de pulmonale kapillærer en diameter på 8-15 gm, hvorimod kapillærerne ved HPS kan være dilateret til op mod 100 gm. I tillæg ses, i varierende grad, pulmonale arteriovenøse shunts og portopulmonal anastomosering.
1.3. DEFINITION
HPS defineres ved triaden:
- Forøget alveolar-arteriel oxygengradient (A-a O2
- Påvist leversygdom
- Påviste intrapulmonale vaskulære dilatationer (IPVD)
1.3.1. Forøget A-a O2 gradient
- gradient Ved type 1 respirationssvigt (hypoxæmisk respirationssvigt) vil A-a O2 gradienten øges i modsætning til type 2 respirationssvigt (hyperkapnisk respirationssvigt). En øget A-a O2 gradient er obligatorisk for at stille diagnosen HPS.
Gradienten kan udregnes med formlen:
A-a O2gradient = PAO2– PaO2
hvor PaO2kan bestemmes ved arteriegasanalyse og PAO2 beregnes som:
PAO2 = (Patm – PH2O) x (FiO^ – (PaCO2/RQ)
hvor Patmer det atmosfæriske tryk, PH2Oer H2Os partialtryk i alveoleluften, FiO2er fraktionen af inspireret O2, PaCO2er arterielt partialtryk af CO2og RQ er respirationskvotienten. A-a O2gradienten kan udregnes fra en arteriel blodgasanalyse. Alternativt kan en af de mange tilgængelige kalkulatorer på internettet anvendes. En A-a O2gradient > 15 mmHg (2 kPa) anses generelt som værende forøget.
1.3.2. Leversygdom
De fleste patienter med HPS har underliggende levercirrose med varierende grad af portal hypertension. HPS er ikke associeret til en bestemt ætiologi af levercirrose og der er ligeledes ingen klar sammenhæng mellem sværhedsgraden af evt. leverfunktionsnedsættelse og udvikling af HPS. HPS kan også forekomme ved patienter med portal hypertension uden samtidig forekomst af levercirrose, herunder ekstrahepatisk trombose af vena porta samt Budd-Chiari syndrom. Endelig er HPS også beskrevet ved leversygdomme, hvor den portale hypertension ikke synes fremtrædende, som f.eks. viral hepatitis uden sekundær levercirrose. Sammenfattende kan HPS optræde som led i en række forskellige leversygdomme og bør haves in mente uafhængigt af ætiologi og sværhedsgrad af den bagvedliggende leversygdom.
1.3.3. Påvisning af IPVD
I klinisk praksis kan IPVD påvises ved enten konstrastekkokardiografi (transthorakal eller transøsofageal) eller perfusionsskintigrafi. Valget baseres ofte på lokal ekspertise og metoderne er i praksis ligeværdige. Princippet bag begge undersøgelser er, at lungekapillærernes normale diameter er mindre end indgivet kontrast eller sporstof som derfor ikke kan passere lungekredsløbet. Ved HPS medfører kapillærdilatationen at kontrastmidlernes diameter er relativt mindre og derfor frit kan passere gennem lungekredsløbet. Ved begge de anførte metoder søger man således at påvise kontrastmiddel eller sporstof der har passeret igennem lungekredsløbet som tegn på IPVD.
1.3.3.1 Kontrastekkokardiografi
Hvis en sprøjte med isoton NaCl rystes kraftigt, dannes små mikrobobler i sprøjten som fungerer som ultralydskontraststof. Ved HPS vil mikroboblerne passere frit gennem det dilaterede lungekredsløb til venstre atrium og venstre ventrikel og kan der visualiseres som små hyperekkoiske partikler. Dermed kan man indirekte påvise eller ekskludere IVPD. Principielt ses samme fund dog også ved andre former for venoarteriel shunt. Ved kardiel shunt vil mikroboblerne typisk ses tidligere i venstre side end ved intrapulmonal shunt. Tolkning og udførelse af ultralydsskanning med kontrast kræver specialkompetence og bør udføres af en trænet undersøger, eventuelt efter henvisning til kardiologisk afdeling. I modsætning til perfusionsskintigrafi, er det med kontrast- ekkokardiografi vanskeligt præcist at beregne shuntfraktionen.
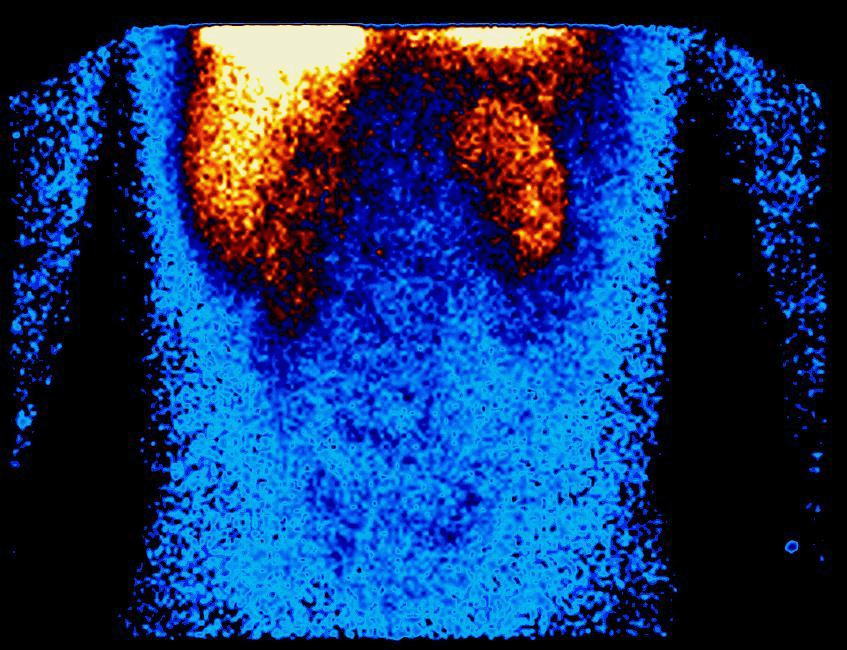
Figur 1. Perfusionsskintigrafi hos patient med hepatopulmonalt syndrom. Sporstof ses foruden i lunger også tydeligt i nyrerne og leveren.
Gengivet med tilladelse fra Nuklearmedicinsk Afdeling, Odense Universitetshospital.
Ved kontrastekkokardiografi er der, hos patienter med shunt, beskrevet enkelte tilfælde (1 -2 %o) med mindre apopleksi og transitorisk cerebral iskæmi (TCI) kort efter undersøgelsen. Patienten skal derfor informeres om risikoen for apopleksi og TCI forud for proceduren.
1.3.3.2 Perfusionsskintigrafi
Ved perfusionsskintigrafi er diagnostik og kvantificering af IPVD baseret på technetium-99m- mærket makroaggregeret albumin, der injiceres intravenøst som ved konventionel lungeskintigrafi. Disse molekyler er 20-90 gm i diameter og vil således retineres næsten fuldstændigt i et normalt kalibreret lungekredsløb. Dette anvendes ved konventionel lungeskintigrafi, hvor man vil kunne se perfusionsdefekter ved lungeemboli. Under normale forhold vil intet sporstof erkendes i systemkredsløbet, men hvis der foreligger IPVD passerer en vis andel af sporstoffet kapillærnettet og fordeles i systemkredsløbet, hvor det ved gammakameraoptagelser kan påvises i ekstrapulmonale organer som nyrer, hjerne, lever og milt (figur 1). Metoden tillader desuden ganske præcis beregning af shuntfraktion, men kan ikke skelne kardiel shunt fra intrapulmonal shunt. Shuntfraktionen kan beregnes fra formlen:
(GMBC/0,13)/((GMBC/0,13) + GMLC)
hvor GMBC er den målte radioaktivitet i hjernen (tælletallet beregnet som geometric mean), GMLC er tælletallet over lungerne (geometric mean) og 0,13 repræsenterer en formodning om at hjernen modtager 13% af minutvolumen. Ved denne metode er normalværdi hos patient uden shunt <6%. Apopleksi og TCI er ikke rapporteret ved perfusionsskintigrafi, selvom det er en teoretisk komplikation. Stråledosis er ca. 1-2 mSv, som sammenholdt med den naturlige baggrundsstråling for voksne danskere på 3-5 mSv pr. år må betragtes som minimal.
1.4. KLINISKE MANIFESTATIONER OG KARAKTERISTIKA
Hos de fleste patienter med HPS er leversygdommen kendt når dyspnø og hypoxæmi erkendes, men hos et mindretal påvises leversygdommen som følge af udredning af de pulmonale gener.
Som ved mange lungesygdomme, er der kun få specifikke symptomer. Dog er orthodeoxi (dvs. faldende SpO2 ved skift fra liggende til stående stilling, typisk > 5 %) og platypnø (øget åndenød i stående stilling) karakteristiske og ses hos de fleste patienter. Afhængig af graden af V/Q mismatch og eventuelle pulmonale arteriovenøse shunts er responset på iltbehandling varierende, hvor patienter med sidstnævnte pulmonale arteriovenøse shunts responderer dårligst.
Specifikke tegn på leversygdom eller cirrhose (eksempelvis ascites, hepatomegali, spider nævi, palmart erytem, caput medusae og testikelatrofi) findes hos de fleste patienter i mere eller mindre udtalt grad.
1.5. UDREDNING
Udredning for HPS bør overvejes i følgende to kliniske situationer:
- Type I respirationssvigt hos en patient med leversygdom
- Uafklaret type I respirationssvigt hvor initialt udredningsprogram ikke har kunnet påvise årsagen
Den diagnostiske strategi bør rettes mod at påvise triaden der definerer HPS. Såfremt patienten ikke allerede har fået diagnosticeret leversygdom, bør udredning herfor foregå i samråd med speciallæge i gastroenterologi.
Øvrige undersøgelser er hyppigt normale eller uspecifikt abnorme, men det må dog holdes in mente at anden kardiopulmonal komorbiditet er hyppig. Her må individuel vurdering afgøre om der skal foretages supplerende udredning,
eksempelvis hos patient med svær hypoksæmi og KOL i lettere grad hvor symptomer og sygdomsgrad er disproportionale. Røntgen af thorax kan vise uspecifikke basale forandringer, som kan mistolkes som retikulære abnormiteter. IPVD kan ofte ses på HRCT. Spirometri er uden obstruktivitet. Udvidet lungefunktionsundersøgelse viser typisk nedsat DLCO og lettere nedsat TLC.
1.6. DIFFERENTIALDIAGNOSER
Differentialdiagnostisk må først og fremmest overvejes andre lunge-, hjerte- og/eller lungekarsygdomme som vil afsløres ved de rutineundersøgelser der er anført i introduktionen. Af sygdomme som kan ligne HPS, bør kardiel shunt og arteriovenøse malformationer overvejes. I disse tilfælde må transøsofageal ekkokardiografi og pulmonal angiografi typisk gennemføres. Hvis leversygdom påvises i forbindelse med HPS-udredning, bør patienten videreudredes for dette i gastroenterologisk regi.
1.7. BEHANDLING OG PROGNOSE
Eneste effektive behandling for HPS er levertransplantation, der i mange tilfælde medfører bedring af hypoxæmien. Patienten bør, også af denne grund, henvises tidligt til en gastroenterologisk afdeling. Timing af transplantation er vigtig, idet transplantation i sene stadier er associeret med øget mortalitet. Ved hypoxæmi er iltbehandling indiceret, om end iltbehandling ved HPS ikke er evidensbaseret. Tilstanden er som hovedregel ikke spontant reversibel, og mortaliteten er høj. Dødsårsagen er oftest multifaktoriel hvor leversygdommen og komplikationer hertil typisk er medvirkende.
1.8. REFERENCER
Abrams GA, Jaffe CC, Hoffer PB et al. Diagnostic utility of contrast echocardiography and lung perfusion scan in patients with hepatopulmonary syndrome. Gastroenterology 1995;109(4):1283-8.
Bommer WJ, Shah PM, Allen H et al. The safety of contrast echocardiography: report of the Committee on Contrast Echocardiography for the American Society of Echocardiography. J Am Coll Cardiol 1984;3:6-13.
Palma DT, Fallon MB. The hepatopulmonary syndrome. J Hepatol 2006;45:617-25.
Rodríguez-Roisin R, Krowka MJ. Hepatopulmonary syndrome-a liver-induced lung vascular disorder. N Engl J Med 2008;358(22):2378-87.
Spagnolo P, Zeuzem S, Richeldi L et al. The complex interrelationships between chronic lung and liver disease: a review. J Viral Hepat 2010;17(6):381-90.
Rodrigues-Roisin R, Krowka MJ, Herve P et al. Pulmonary-hepatic vascular disorders. Eur Respir J 2004;24:861-80.
Schenk P, Fuhrmann V, Madl C et al. Hepatopulmonary syndrome: prevalence and predictive value of various cut offs for arterial oxygenation and their clinical consequences. Gut 2002;51:853-859.
Krishnamurthy GT, Krishnamurthy S. Chap. 5: Imaging and Quantification of Hepatobiliary Function. I: Kristnamurthy GT, Kristnamurthy S. Nuclear Hepatology. A Textbook of
Hepatobiliary Diseases. Berlin: Springer, 2009;160–66.